
| A、x=10时,溶液中有NH4+、Al3+、SO42-,且c( NH4+)>c(Al3+) |
| B、x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-) |
| C、x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+) |
| D、x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)=c(Ba2+) |


科目:高中化学 来源: 题型:
2- 4 |
| ||
| ①转化 |
2- 7 |
| ||
| ②还原 |
| ||
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
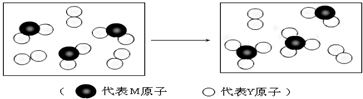
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| B、电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| C、多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
| D、CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
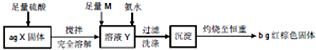
| A、取少量溶液Y,加入KSCN溶液,如果溶液不变红,则X中不含Fe3O4 | ||
| B、向钾氨水后得溶液中滴加FeCl2,如果生成红褐色沉淀,说明氨水已过量 | ||
| C、m可以是H2O2或NaClO,在实验过程中,理论上消耗两者物质的量之比为1;2 | ||
D、当b<
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取氢氧化钠20.0 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗 |
| D、移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
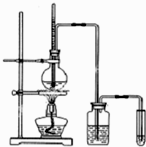 下面是实验室制乙烯并检验其性质的装置图,请回答:
下面是实验室制乙烯并检验其性质的装置图,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com