
| A、14.2g |
| B、19.6g |
| C、28.4g |
| D、30.4g |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
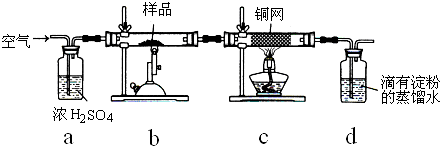
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过滤的方法分离Fe(OH)3胶体和HCl溶液 |
| B、用托盘天平称取25.12gNaCl固体 |
| C、分别含有Mg2+、Cu2+和Na+的三种盐溶液,用NaOH溶液就能一次鉴别开 |
| D、从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
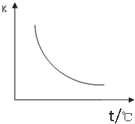 工业上制备H2的一种重要方法是:CO( g)+H2 O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数 K 与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质 的浓度(mol?L-1)随时间的变化关系如表:
工业上制备H2的一种重要方法是:CO( g)+H2 O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数 K 与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质 的浓度(mol?L-1)随时间的变化关系如表:| 时间/min | CO(g) | H2O | CO2 | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.238 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C1 | C1 |
| 4 | C1 | C2 | C1 | C1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在多电子的基态原子中,不可能有运动状态完全相同的两个电子存在 |
| B、在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C、在多电子的基态原子中,能量最高的电子往往是距离原子核最近的电子 |
| D、对于多电子原子,其核外电子完全按能层次序排布,填满一个能层才开始填下一能层 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
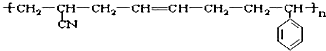 其单体可能是( )
其单体可能是( )| A、①③⑤ | B、②③⑤ |
| C、①②⑥ | D、①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com