
| A、Na+、K+、Cl-、SO42? |
| B、Cu2+、K+、SO42-、NO3- |
| C、K+、NH4+、SO42-、CO32? |
| D、Ba2+、Na+、Cl-、SO42- |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:

| A、原子半径:X<Y<Z |
| B、X、Y、Z三种元素的最高价氧化物对应水化物中最多有一种强酸 |
| C、X的气态氢化物的稳定性比Y的气态氢化物强 |
| D、常温下X、Y、Z的单质不可能均与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu(OH)2和HNO3 |
| B、Ba(OH)2与H2SO4 |
| C、CO2和NaOH溶液 |
| D、KHSO4和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| ||
| ①转化 |
2- 7 |
| ||
| ②还原 |
| ||
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、SO42-、OH- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、Na+、Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
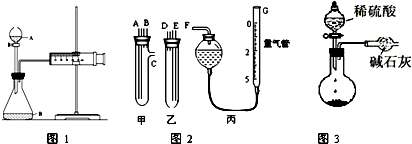
查看答案和解析>>
科目:高中化学 来源: 题型:
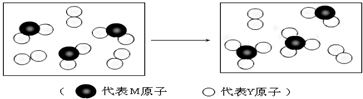
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取氢氧化钠20.0 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗 |
| D、移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com