
| A、Cu(OH)2和HNO3 |
| B、Ba(OH)2与H2SO4 |
| C、CO2和NaOH溶液 |
| D、KHSO4和NaOH |


科目:高中化学 来源: 题型:
| A、邻二甲苯不可用作生产X的原料 |
| B、Y可发生银镜反应 |
| C、Y可与FeCl3发生显色反应 |
| D、Z与X的相对分子质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH- | ||||
B、用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O
| ||||
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | ||||
| D、钢铁发生电化学腐蚀的负极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C |
| 产生白色沉定,溶液仍为蓝色 | 产生蓝色沉定,溶液变为无色 | 产生蓝色沉淀,溶液为无色 |
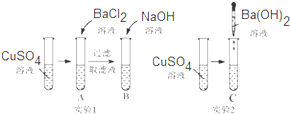
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)现有以下物质①NaOH溶液 ②干冰 ③稀硫酸 ④铜 ⑤醋酸 ⑥BaSO4固体 ⑦蔗糖 ⑧食盐晶体 ⑨酒精 ⑩熔融的KNO3,其中属于电解质的是:
(1)现有以下物质①NaOH溶液 ②干冰 ③稀硫酸 ④铜 ⑤醋酸 ⑥BaSO4固体 ⑦蔗糖 ⑧食盐晶体 ⑨酒精 ⑩熔融的KNO3,其中属于电解质的是:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA | ||
B、标准状况下,a L的氧气和氮气的混合物含有的分子数为(
| ||
| C、60 g SiO2晶体中含有2NA个Si-O键 | ||
| D、标准状况下,11.2 L乙醇完全燃烧产生的CO2的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、Cl-、SO42? |
| B、Cu2+、K+、SO42-、NO3- |
| C、K+、NH4+、SO42-、CO32? |
| D、Ba2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在豆浆里加入盐卤做豆腐 |
| B、在河流入海处易形成沙洲 |
| C、“尿毒症”患者做血液透析治疗 |
| D、三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com