汽车尾气是造成雾霾天气的重要原因之一.已知:
①N
2(g)+O
2(g)?2NO(g)△H
1②2NO(g)+O
2(g)?2NO
2(g)△H
2③CO
2(g)?CO(g)+
O
2(g)△H
3④2CO(g)+2NO(g)?N
2(g)+2CO
2(g)△H
4请完成以下问题:
(1)请根据反应①②③,确定反应④中△H
4=
.
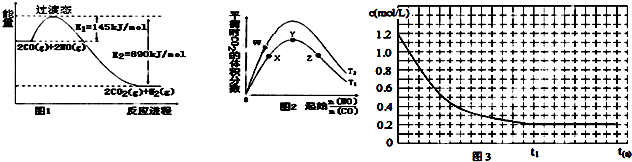
(2)根据图1,反应④的热化学方程式为:
.该反应在
(填“高温”“低温”或“任意温度”)下有利于该反应正向自发.
(3)图2表示反应④的反应物NO、CO的起始物质的量比、温度对平衡时CO
2的体积分数的影响.
①W、Y、Z三点的平衡常数的大小关系为:
,X、Y、Z三点,CO的转化率由大到小的顺序是
②T
1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K=
(算出数值).若此温度下,某时刻测得CO、NO、N
2、CO
2的浓度分别为0.01mol/L
a mol/L、0.01mol/L、0.04mol/L,要使反应向正方向进行,a的取值范围为
.
(4)恒温恒容时,反应④中NO、CO按一定比例投料,反应过程中CO浓度随时间的变化关系如图3所示,请在同一图中绘出N
2浓度随时间的变化曲线.


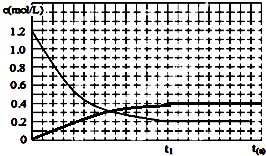 ,故答案为:
,故答案为: .
.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案