
【题目】某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是( )
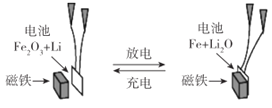
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液做电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电时,电池被磁铁吸引
科目:高中化学 来源: 题型:
【题目】酒精灯给试管里的物质加热时,发现试管破裂可能的原因有:①用酒精灯的外焰加热;②加热时试管外壁的水没有擦干;③加热时试管底部接触灯芯;④被加热的液体超过试管容积的![]() ;⑤加热液体时没有不时的上下移动试管;⑥没有进行预热,直接集中加热试管里的物质;⑦加热固体时试管口向上倾斜。其中与之相关的是( )
;⑤加热液体时没有不时的上下移动试管;⑥没有进行预热,直接集中加热试管里的物质;⑦加热固体时试管口向上倾斜。其中与之相关的是( )
A.②③⑤⑦B.②④⑤⑥C.②③⑥⑦D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3-+ Ca2+ + 2OH-= CaCO3↓+ CO32- + 2H2O
D.醋酸钠水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:
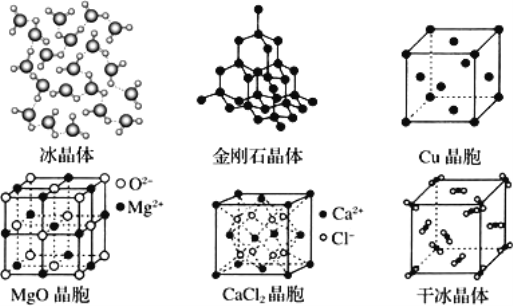
请回答下列问题:
(1)a:冰、b:金刚石、c:MgO、d:CaCl2、e:干冰 5 种晶体的熔点由高到低的顺序为________
(2)金刚石晶胞中若碳原子半径为 r,根据硬球接触模型,列式表示碳原子在晶胞中的空间占有率________(计算结果为含 π 的分数,不要化为小数或百分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于盐类水解反应的说法正确的是( )
A.溶液呈中性的盐一定是强酸与强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小
D.Na2S水解的离子方程式为:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
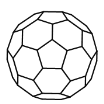
A.0.1 mol C3H9N中所含共用电子对数目为1.2NA
B.14 g N60(分子结构如图所示)中所含N-N键数目为1.5NA
C.某温度下,1 L pH=6的纯水中所含OH数目为1.0×108 NA
D.标准状况下,5.6 L甲醛气体中所含的质子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。回答下列问题:
(1)Mg、Ni、Cu 等金属可能形成金属互化物。金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、 “等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2 中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键
(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
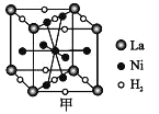
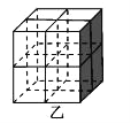
该合金储氢后,H2 与 Ni 的物质的量之比为___________。
②Mg2NiH4 是一种储氢的金属氢化物。在 Mg2NiH4 晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。 晶体的密度为ρg·cm-3,NA表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 NA 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com