
【题目】化合物V的合成路线如下(反应条件、部分生成物省略):

(1)化合物I的分子式为__________,1mol该物质完全燃烧需消耗__________molO2。
(2)反应①的化学方程式为__________(不要求注明反应条件)。
(3)下列说法正确的是__________(填字母)。
A.化合物Ⅰ~Ⅴ均属于芳香烃衍生物
B.反应③属于加成反应
C.化合物Ⅱ和化合物Ⅴ均能使溴的四氯化碳溶液褪色
D.化合物Ⅴ能与NaOH溶液反应
(4)反应②还会生成化合物Ⅲ的同分异构体,该同分异构体的结构简式为__________。
(5)该合成工艺中可以循环利用的有机物是__________。
【答案】 C7H14O 10 2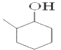 +O2→2
+O2→2 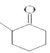 +2H20 BD
+2H20 BD 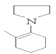
![]()
【解析】(1)根据结构简式确定分子式,根据燃烧通式计算耗氧量;
(2)反应①是醇羟基发生催化氧化;
(3)A.芳香烃衍生物含有苯环;
B.对比Ⅲ、Ⅳ的结构可知,反应③属于加成反应;
C.化合物Ⅱ、Ⅴ不能使溴的四氯化碳溶液褪色;
D.化合物Ⅴ含有酯基,能与NaOH溶液反应;
(4)根据化合物Ⅱ中与羰基碳相邻的碳原子位置不同分析;
(5)反应④中生![]() ,而反应②中
,而反应②中![]() 参与反应。
参与反应。
(1)根据I的结构简式可知其分子式为C7H14O。1mol 该物质完全燃烧的耗氧量为(7+14/4-1/2)mol=10mol;
(2)反应①是醇羟基发生催化氧化,反应方程式为2![]() +O2→2
+O2→2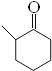 +2H20;
+2H20;
(3)A.化合物Ⅰ~Ⅴ均没有苯环,不属于芳香烃衍生物,A错误;
B.对比Ⅲ、Ⅳ的结构可知,反应③属于加成反应,B正确;
C.化合物Ⅱ、化合物Ⅴ含有羰基,不能使溴的四氯化碳溶液褪色,C错误;
D.化合物Ⅴ含有酯基,能与NaOH溶液反应,D正确。
答案选BD;
(4)由于化合物Ⅱ中与羰基碳相邻的碳原子位置不同,因此该同分异构体的结构简式为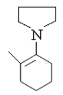 。
。
(5)反应④中生成![]() ,而反应②中
,而反应②中![]() 参与反应,可以循环利用的物质是
参与反应,可以循环利用的物质是![]() 。
。


科目:高中化学 来源: 题型:
【题目】工业上用粗制的氧化铜粉末(含杂质Fe和SiO2)来制取无水CuCl2的工艺流程如图所示:
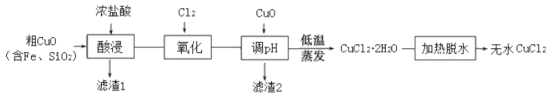
(1)“酸浸”时发生的复分解反应化学方程式为:____。为加快酸浸速率可以采取的措施是:____(任举一条)。
(2)“氧化”时发生的离子方程式为:_____。
(3)下表列出了相关金属离子生成氢氧化物沉淀的pH。“调pH”时应控制溶液pH范围为_____。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 5 | 3. 7 |
Cu2+ | 4.2 | 6. 4 |
Fe2+ | 6.5 | 9.7 |
当pH=4时,溶液中c(Fe3+)=____。已知:Ksp[Fe(OH)3]=2.6×10―39
(4)“加热脱水”需要提供的条件为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
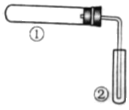
①中实验 | ②中现象 | |
A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列过程的ΔH和ΔS,用“> 0”或“< 0”来表示
化学方程式 | ΔH | ΔS |
H2O(l)→H2O(g) | _________ | ________ |
CaCO3(s) == CaO (s) + CO2(g) | _______ | _______ |
NaOH(s)== Na+(aq)+OH-(aq) | _______ | ________ |
N2(g)+3H2(g) | ______ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、Fe3+、SO42-、SCN-B.H+、Fe2+、SO42-、NO3-
C.Ca2+、Al3+、NO3-、Cl-D.K+、NH4+、CO32-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇能发生如下反应:
①CH3CH2OH+3O2![]() 2CO2+3H2O;
2CO2+3H2O;
②2Cu+O2 ![]() 2CuO,CH3CH2OH+CuO
2CuO,CH3CH2OH+CuO![]() CH3CHO+H2O+Cu。
CH3CHO+H2O+Cu。
由以上反应不能得出的结论是
A. 由反应①②可知,条件不同,乙醇与O2反应的产物不同
B. 由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C. 由反应①可知,乙醇燃烧时,碳碳键、碳氢键、氢氧键均断裂
D. 由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在75℃左右,用HgS04做催化剂,乙炔可水化为乙醛,但HgS04遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、Hg0粉末五种物质制乙醛,装置如下图所示,请回答下列问题:

(1)实验开始时,仪器A中盛放电石,B中应装__________,其作用是__________。
(2)仪器D中盛放水,其作用是__________。
(3)蒸馏烧瓶F中应加入Hg0和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括Hg0在内的各试剂的名称____________________。
(4)装置图中,加热F的方法叫__________,所选用温度计G的量程表示正确的是________(填字母)。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃ D.50℃~100℃ E.0℃~360℃
(5)检验乙醛已制出的操作及现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g2H2O中含有的中子数为10NA
B. 11.2 LCl2与足量NaOH 溶液反应时转移的电子数为0.5 NA
C. 1mol·L-1的Fe2(SO4)3溶液中含有的SO42-数为3 NA
D. 7 g 乙烯和丁烯的混合气体中所含的碳原子数是0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X.Y.Z.M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)Z元素是__________,写出Y2+离子的结构示意图_________________,写出单质Y与单质M反应生成物的电子式________________________。
(2)写出单质X与单质M在高温下反应的生成物的化学式为________,该产物分子为________形(填“直线”.平面三角等”),其化学键属________共价键(填“极性”或“非极性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com