
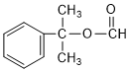
【题目】对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体,某兴趣小组利用中学的简单有机物进行合成,其方案如下:
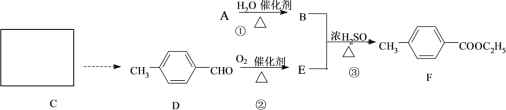
(1)A的结构简式是______________,E中含有的官能团名称是_____________。
(2)C是芳香烃,核磁共振氢谱显示有四种峰,C的结构简式是_____________。
(3)指出化学反应类型:①_______________;②_______________。
(4)丁子香酚( 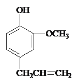 )是一种重要的调味剂,它与F的关系是____________。
)是一种重要的调味剂,它与F的关系是____________。
a. 同系物 b. 同分异构体 c. 同种物质
(5)下列物质不能与丁子香酚发生反应的是____________。
a. NaOH溶液 b. NaHCO3溶液 c. Br2的四氯化碳溶液 d. 乙醇
(6)写出反应③的化学方程式:___________________________________________。
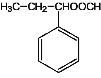
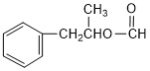
(7)写出能同时满足下列条件F的同分异构体结构简式。_________________
a.与F有相同官能团 b.能发生银镜反应 c.苯环上只有一个取代基
【答案】CH2=CH2 羧基 ![]() 加成反应 氧化反应 b bd
加成反应 氧化反应 b bd ![]()
 、
、 、
、 、
、 、
、
【解析】
B和E在浓硫酸存在条件下加热反应生成F,由F的结构可知,B、E应该为CH3CH2OH和![]() ,A与水发生加成反应生成B,则A的结构简式为:CH2=CH2,据此解答;
,A与水发生加成反应生成B,则A的结构简式为:CH2=CH2,据此解答;
由丁子香酚的结构 可知,分子中含有酚羟基,能与NaOH、碳酸钠反应,酸性比碳酸弱,不能与NaHCO3溶液反应;含有C=C双键,能与溴发生加成反应,据此进行解答。
可知,分子中含有酚羟基,能与NaOH、碳酸钠反应,酸性比碳酸弱,不能与NaHCO3溶液反应;含有C=C双键,能与溴发生加成反应,据此进行解答。
(1)由上述分析可知,A为CH2=CH2,E为![]() ,含有羧基,
,含有羧基,
故答案为:CH2=CH2;羧基;
(2)C是芳香烃,核磁共振氢谱显示有四种峰,结合D的结构可知,C的结构简式是![]() ,
,
故答案为:![]() ;
;
(3)反应①是乙烯与水发生加成反应生成乙醇,属于加成反应;
反应②是![]() 中-CHO氧化为-COOH生成
中-CHO氧化为-COOH生成![]() ,属于氧化反应,
,属于氧化反应,
故答案为:加成反应;氧化反应;
(4)丁子香酚(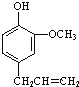 )与F含有的官能团不同,结构不同、分子式相同,互为同分异构体,
)与F含有的官能团不同,结构不同、分子式相同,互为同分异构体,
故答案为:b;
(5)由丁子香酚的结构可知,分子中含有酚羟基,能与NaOH反应,酸性比碳酸弱,不能与NaHCO3溶液反应,含有C=C双键,能与溴发生加成反应,不能与乙醇反应,
故答案为:bd;
(6)反应③是![]() 与乙醇发生酯化反应生成
与乙醇发生酯化反应生成![]() ,反应方程式为:
,反应方程式为:![]() ,
,
故答案为:![]() ;
;
(7)同分异构体含有苯环,且能够发生银镜反应,含有-CHO,其与F含有相同的官能团,故含有![]() ,苯环侧链只有一个取代基,故其结构有:
,苯环侧链只有一个取代基,故其结构有: 、
、 、
、 、
、 、
、 ,
,
故答案为: 、
、 、
、 、
、 、
、 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橘子汁等物质来探究原电池的组成,下列结论不正确的是
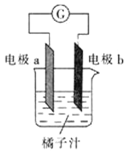
A.若a为铝片,b为锌片或铜片,则导线中一定产生电流
B.若a为锌片,b为铝片,则b极上的电极反应式为![]()
C.原电池是将化学能转化为电能的装置
D.若a、b均为铝片,则电流计指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是( )
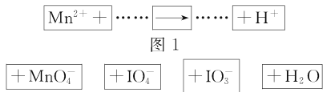
A.![]() 作氧化剂B.若有
作氧化剂B.若有![]() 参加反应转移
参加反应转移![]() 电子
电子
C.氧化剂与还原剂的物质的量之比为5∶2D.配平后![]() 、
、![]() 的化学计量数分别为2、3
的化学计量数分别为2、3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.7.8 g 的Na2S和Na2O2的混合物中含有阴、阳离子总数为0.3NA
B.常温常压下,22.4 LCO2 中含有NA个CO2 分子
C.1.0 L 1.0mol·L-1的 NaClO水溶液中含有的氧原子数为NA
D.常温常压下,18 g 羟基(-17OH)中所含的中子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为____________
(2)已知HN3是一种弱酸,其在水溶液中的电离方程式为HN3![]() H++N3-,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为___________。
H++N3-,与N3-互为等电子体的一种分子为:_______,N3-离子杂化类型为___________。
(3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+ 的配位数是___________,1mol该配离子中所含σ键的数目为____,配位体NH3的空间构型为:___________ 。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________。
(5)NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
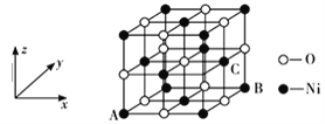
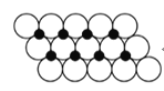
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如下图),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )
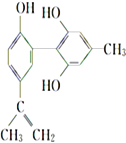
A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 该分子中的所有碳原子一定共平面
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol
D. 滴入KMnO4酸性溶液,观察到紫色褪去,能证明结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,金属(M)—空气电池具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为![]() 。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )
。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A.电池放电过程中正极发生还原反应
B.比较![]() 、
、![]() 、
、![]() 三种金属—空气电池,
三种金属—空气电池,![]() -空气电池的理论比能量最高
-空气电池的理论比能量最高
C.为防止负极区沉积![]() ,宜采用中性电解质及阳离子交换膜
,宜采用中性电解质及阳离子交换膜
D.多孔电极可提高电极与电解质溶液的接触面积,提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用邻苯二甲酸氢钾溶液来滴定NaOH溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是________,选用指示剂是________。
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:

某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是__________。
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作__________;滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.紫外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析
B.高聚物(![]() )属于可降解材料,工业上是由单体经过缩聚反应合成
)属于可降解材料,工业上是由单体经过缩聚反应合成
C.通过煤的液化可获得煤焦油、焦炭、粗氨水等物质
D.石油裂解的目的是为了提高轻质油的质量和产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com