
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
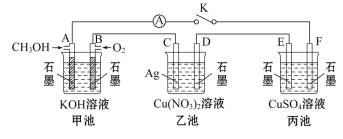
(1)甲池中A电极的电极反应式为________。
(2)丙池的总离子反应方程式为_________。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗标准状况下O2的体积为_____mL。
(4)一段时间后,断开电键K,下列物质能使乙池电解质溶液恢复到反应前浓度的是______(填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
【答案】CH3OH+8OH--6e- == CO32- +6H2O 2Cu2++2H2O![]() 4H++2Cu+O2↑ 560 A
4H++2Cu+O2↑ 560 A
【解析】
由图可知,当闭合该装置的电键K时,甲池为甲醇燃料电池,通入甲醇的为负极,电极反应为:2CH3OH+16OH--12e-=CO32-+12H2O,通入氧气的为正极,电极反应为:3O2+12e-+6H2O=12OH-,KOH为电解质溶液;乙池为电解池,C为阳极,电极反应为:Ag-e-=Ag+,D为阴极,电极反应为:Cu2++2e-=Cu;丙池为电解池,E为阳极,电极反应为:4OH--4e-=O2↑+2H2O,F为阴极,电极反应为:Cu2++2e-=Cu,据此进行分析解答。
(1)甲池为甲醇燃料电池,A为负极,电极反应为:CH3OH+8OH--6e- == CO32- +6H2O;
(2)丙池为电解池,E为阳极,电极反应为:4OH--4e-=O2↑+2H2O,F为阴极,电极反应为:Cu2++2e-=Cu,总离子反应方程式为:2Cu2++2H2O![]() 4H++2Cu+O2↑
4H++2Cu+O2↑
(3)甲池B极为正极,电极反应为:3O2+12e-+6H2O=12OH-,乙池中C为阳极,电极反应为:Ag-e-=Ag+,乙池中C极质量减轻10.8 g,n(Ag)=![]() =0.1mol,电子转移0.1mol,甲池中消耗氧气的物质的量为
=0.1mol,电子转移0.1mol,甲池中消耗氧气的物质的量为![]() ×0.1mol=0.025mol,消耗标准状况下O2的体积为0.025mol×22.4L/mol=0.56L=560mL;
×0.1mol=0.025mol,消耗标准状况下O2的体积为0.025mol×22.4L/mol=0.56L=560mL;
(4)乙池为电解硝酸铜,用金属银作阳极,阴极上铜离子得电子生成单质铜,溶液中铜离子减少,要让乙池电解质溶液恢复到反应前浓度,需要加入金属铜。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:

(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中充入3 mol Z,发生反应:3Z(g) ![]() 2X(g)+Y(g) ΔH<0,反应过程中持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示。下列推断正确的是
2X(g)+Y(g) ΔH<0,反应过程中持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示。下列推断正确的是
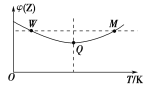
A.升高温度,平衡常数增大
B.W点时,Z的正反应速率等于Z的逆反应速率
C.Q点时,Z的转化率最大
D.平衡时在相同条件下再充入Z,则达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下:

已知P4与两种碱的反应主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑ Ⅱ. 4NaOH + P4+8H2O = 4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH + P4+2H2O = 2Na2HPO3 +2PH3↑ Ⅳ. NaH2PO2+NaOH = Na2HPO3+H2↑
(1) 已知H3PO2是一元中强酸,NaH2PO2是___________(填“正盐”或“酸式盐”)。
(2)尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,从吸收液中获得NaH2PO2·H2O的操作为______________、______________过滤、洗涤和干燥。
(3) 用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为:______________________。
(4) “反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)/ n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)/ n(磷)>2.6时,NaH2PO2的产率随n(碱)/ n(磷)的增大而降低的可能原因是______。

(5) 滤渣2主要成分为___________________ (填化学式)。
(6) “过滤2”的滤液须用Ag2SO4、Ba(OH) 2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是_________________。
(7)在工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极反应式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
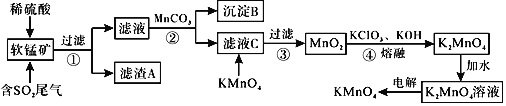
【题目】![]() 是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿
是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿![]() 主要成分
主要成分![]() ,还有
,还有![]() 、
、![]() 、
、![]() 等
等![]() 作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程既脱除燃煤尾气中的![]() ,又制得
,又制得![]() 反应条件已经省略
反应条件已经省略![]() 。
。
已知:![]() ,
,![]() 回答下列问题:
回答下列问题:
![]() 滤渣A的成分是
滤渣A的成分是![]() 写化学式
写化学式![]() ______。
______。
![]() 析出沉淀B时,首先析出的物质是
析出沉淀B时,首先析出的物质是![]() 写化学式
写化学式![]() ______。
______。
![]() 步骤2中加入
步骤2中加入![]() 的作用为______。
的作用为______。
![]() 滤液C中加入
滤液C中加入![]() 时发生反应的离子方程式是______。
时发生反应的离子方程式是______。
![]() 完成步骤4中反应的化学方程式______
完成步骤4中反应的化学方程式______![]() ______
______![]() ______
______![]() ______
______
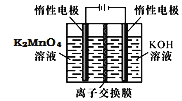
![]() 电解制备
电解制备![]() 的装置如图所示。电解液中最好选择______离子交换膜
的装置如图所示。电解液中最好选择______离子交换膜![]() 填“阳”或“阴”
填“阳”或“阴”![]() 。电解时,阳极的电极反应式为______。
。电解时,阳极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为____________,若将负极材料改为CH4,写出其负极反应方程式______________。
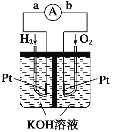
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是多种高级脂肪酸的甘油酯。油脂的下列性质和用途中,与其含有不饱和的碳碳双键有关的是( )
A.油脂是产生能量最高的营养物质
B.利用油脂在碱性条件下的水解,可以制甘油和肥皂
C.植物油通过氢化(加氢)可以变为脂肪
D.脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰![]() 的化学性质与卤素
的化学性质与卤素![]() 很相似,化学上称之为拟卤素,其氧化性介于
很相似,化学上称之为拟卤素,其氧化性介于![]() 和
和![]() 之间,下列有关反应方程式正确的是
之间,下列有关反应方程式正确的是
A.![]() 和KCN溶液之间不发生反应
和KCN溶液之间不发生反应
B.向KCN溶液中加入碘水:![]()
![]()
![]()
C.![]() 和HCN反应:
和HCN反应:![]() 浓
浓![]()
![]()
![]()
D.在NaI和KCl混合溶液中通入少量![]() :
:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com