
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次递增。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D四种元素第一电离能最大的是_______________。
(2)B的氯化物的熔点比D的氯化物的熔点__________(填“高”或“低”),理由是
__________________________________________________。
(3)E的低价氧化物分子的立体构型是_________________,用KMnO4酸性溶液吸收该氧化物时,MnO4-被还原为Mn2+,该反应的离子方程式为______________________________________。
(4)F的核外电子排布式是___________。
(5)A、F形成某种化合物的晶胞结构如下图所示(其中A显-3价),该化合物的化学式是_________________,若晶胞边长为a cm,阿伏伽德罗常数为NA,则该晶体的密度计算式为ρ=___________g/cm3(用含a、NA的符号表示)。

【答案】 N 高 NaCl为离子晶体,而SiCl4为分子晶体 V形 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 1s22s22p63s23p63d104s1(或[Ar]3d104s1) Cu3N ![]()
【解析】A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.A原子核外有三个未成对电子,其电子排布式为1s22s22p3,为N元素,E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,应为S元素,C元素是地壳中含量最高的金属元素,为Al元素,化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,应为Na元素,D单质的熔点在同周期元素形成的单质中是最高的,应为Si元素,单质硅为原子晶体,熔点在第三周期中最高,F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为1s22s22p63s23p63d104s1,应为Cu元素;
(1)在元素周期表中,同一周期元素的第一电离能从左到右逐渐增大,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Na<Al<Si<N;
(2)因NaCl为离子晶体而SiCl4为分子晶体,原子晶体的熔沸点远大于分子晶体的熔沸点;
(3)SO2分子中原子之间形成2对共用电子对,含有σ键、π键,S原子价层电子对数=2+![]() =3,则S原子杂化轨道数目为3,S原子采取sp2杂化,分子的空间构型是V形,用KMnO4酸性溶液吸收该SO2时,MnO4-被还原为Mn2+,SO2被氧化为SO42-,则该反应的离子方程式为5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
=3,则S原子杂化轨道数目为3,S原子采取sp2杂化,分子的空间构型是V形,用KMnO4酸性溶液吸收该SO2时,MnO4-被还原为Mn2+,SO2被氧化为SO42-,则该反应的离子方程式为5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
(4)根据能量最低原理书写电子排布式为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);
(5)晶胞中Cu原子数目=12×![]() =3、N原子数目=8×
=3、N原子数目=8×![]() =1,故化学式为:Cu3N,晶胞的质量=
=1,故化学式为:Cu3N,晶胞的质量=![]() g,则晶胞棱长=a cm,则晶胞体积=(a cm)3,故晶体的密度ρ=
g,则晶胞棱长=a cm,则晶胞体积=(a cm)3,故晶体的密度ρ=![]() g÷(a cm)3=
g÷(a cm)3=![]() g/cm3。
g/cm3。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)G位于周期表的____区(填“s”、“ p”、“d ”或“ds”)。
(2)画出W基态原子的核外电子排布图_______。
(3)A2Y的VSEPR模型名称为______。
(4)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理.写出X2Y的电子式____,其中心原子的杂化软道类型是______,1个X2Y分子中含的π键数为______。
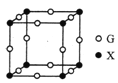
(5)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
(6)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A.3︰2 B.1︰2 C.3︰1 D.6︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 已知, N2 (g) + 3 H2(g)![]() 2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
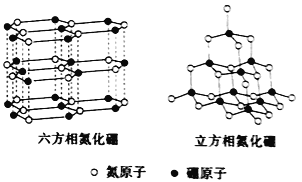
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中存在的作用力均为共价键
D. 两种晶体均为分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于石油、煤、甲烷水合物等资源的说法正确的是
A. 苯是来自于煤的基本化工原料 B. 水煤气是通过煤的液化得到的气体燃料
C. 甲烷水合物是由甲烷和水组成的混合物 D. 石油裂解得到的汽油可萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块铝箔用砂纸打磨表面后,放置一段时间,在酒精灯上加热至熔化,下列说法正确的是( )
A. 熔化的是铝B. 熔化的是Al2O3
C. 熔化物滴落D. 熔化物迅速燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃类化合物是重要的有机合成中间体。下面是某研究小组合成呋喃类化合物的路线:
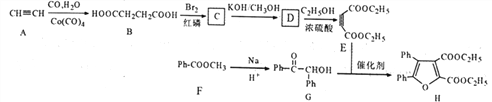
己知:①ph—为苯环
② 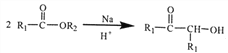
回答下列问题:
(1)下列能用于测定H结构的仪器有___________ 。(填序号)
a.核磁共振仪 b.红外光谱仪 c.质谱仪
(2)G中官能团名称为__________。
(3)E的化学名称是_______,B生成C的反应类型为_______________。
(4)写出由D生成E的化学方程式为___________________。
(5)含有羧基和两个苯环,且两个苯环不直接相连的G的同分异构体共有_____种(不含立体
结构),其中核磁共振氢谱显示为5组峰,峰面积比为4:4:2:1:1的是_____(写结构简式)。
(6)参照上述合成路线,以E和乙醇为原料(无机试剂任选),设计制备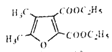 合成路线_______________________。
合成路线_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com