
【题目】某校化学兴趣小组为研究Cl2的性质并制备氯水,用如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。

(1)加入药品前,检查I中气体发生装置气密性的操作是__。
(2)装置Ⅰ中发生反应的化学方程式为__。
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在__和___(填装置序号)之间添加洗气装置,该装置的作用是___。
(4)装置V中NaOH溶液的作用是__,相关反应的化学方程式为___。
(5)反应完毕,为探究装置Ⅳ中溶质的成分,需要的试剂主要有__。
【答案】关闭c,打开分液漏斗的活塞,向分液漏斗中加入适量水,一段时间后分液漏斗液面不再发生变化 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Ⅱ Ⅲ 干燥Cl2 吸收尾气,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O pH试纸、品红溶液、AgNO3溶液(顺序可调)或紫色石蕊溶液、AgNO3溶液(顺序可调)
MnCl2+Cl2↑+2H2O Ⅱ Ⅲ 干燥Cl2 吸收尾气,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O pH试纸、品红溶液、AgNO3溶液(顺序可调)或紫色石蕊溶液、AgNO3溶液(顺序可调)
【解析】
(1)若装置I气密性良好,关闭c,打开分液漏斗的活塞,分液漏斗中液体不能顺利流入烧瓶中;
(2)装置Ⅰ中二氧化锰和浓盐酸反应生成氯化锰、氯气和水;
(3)装置Ⅱ中有水,可能有水蒸气进入Ⅲ;
(4)装置V中NaOH溶液能与氯气反应生成氯化钠、次氯酸钠和水;
(5)装置Ⅳ中溶质是盐酸和次氯酸。
(1)关闭c,打开分液漏斗的活塞,向分液漏斗中加入适量水,一段时间后分液漏斗液面不再发生变化,说明装置I气密性良好;
(2)装置Ⅰ中二氧化锰和浓盐酸反应生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)装置Ⅱ中有水,有水蒸气进入Ⅲ,所以未观察到“a无明显变化”这一预期现象;应在Ⅱ和Ⅲ之间添加盛有浓硫酸的洗气瓶,用于干燥Cl2;
(4)装置V中NaOH溶液能与氯气反应生成氯化钠、次氯酸钠和水,反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;氯气有毒,不能排放到空气中,所以装置V中NaOH溶液的作用是吸收尾气,防止污染环境;
(5)加入紫色石蕊溶液,先变红后褪色,说明含有氢离子、次氯酸,再加入硝酸银溶液,有白色沉淀生成,证明含有氯离子,所以需要加入的试剂是紫色石蕊溶液、AgNO3溶液。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应,计算:
(1)Al的物质的量__________。
(2)参加反应的NaOH的物质的量__________和NaOH溶液的物质的量浓度___________。
(3)生成的H2在标准状况下的体积____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示);
(2)已知 2SO2(g)+O2(g)=2SO3(g)△H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:
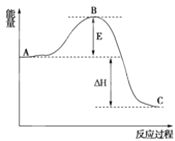
①图中A分别表示______________;
②E的大小对该反应的反应热_________(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点 __________(填“升高”“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
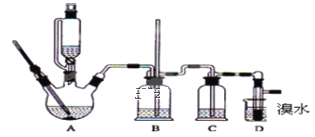
【题目】实验室用少量的溴水和足量的乙烯制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式:___________________________________。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞.请写出发生堵塞时瓶B中的现象:______________________________________________________。
(3)在装置C中应加入_____(填字母),(a.水 b.浓硫酸 c.氢氧化钠溶液)其目的是 ___________________________________________________________________。
(4)若产物中有少量副产物乙醚,可用 ________________ 的方法除去。
(5)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 _________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素具有浓郁的奶香,味微甜,广泛用于食品、巧克力、冰淇淋、饮料以及日用化妆品中起增香和定香作用。下面是一种以甲苯为原料合成香兰素的路线。
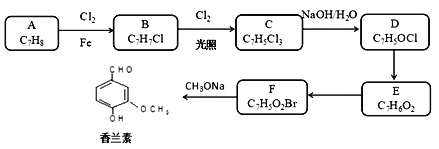
已知:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
②R-NO2![]() R-NH2。
R-NH2。
③R-NH2+R'COOR"![]() R-NHR"。
R-NHR"。
回答下列问题:
(1)下列说法不正确的是________。
A. 化合物A能发生还原反应 B. 化合物E能与碳酸氢钠反应产生气体
C. 化合物F具有弱酸性 D. 香兰素分子中最多12个原子共平面
(2)由F生成香兰素的化学反应方程式为________。
(3)E的结构简式为__________。
(4)写出以甲苯和乙酸乙酯为原料制备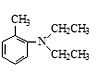 的合成路线____(用流程图表示,无机试剂任选)。
的合成路线____(用流程图表示,无机试剂任选)。
(5)写出比E分子多3个碳原子的同系物的所有同分异构体结构简式,且符合以下要求: _______。
①能使FeCl3溶液显紫色,又能发生银镜反应。②核磁共振氢谱中存在5种氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.用金属钠可以区分乙酸、乙醇和苯
B.不能用酸性KMnO4溶液除去甲烷中的乙烯
C.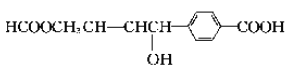 可以发生氧化反应、还原反应、酯化反应、加成反应
可以发生氧化反应、还原反应、酯化反应、加成反应
D.将等物质的量的甲烷和氯气混合后光照充分,生成物最多的是CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )
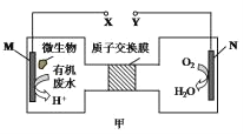
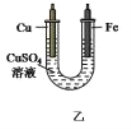
A.铁电极应与Y相连接
B.H+透过质子交换膜由右向左移动
C.乙装置在通电过程中Cu2+浓度在减小
D.M电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行下列不同的操作,请回答有关问题:操作:①只接通K1;②只接通K2;③只接通K3;④都断开。
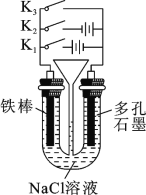
(1)铁棒的腐蚀速率由大到小的顺序是____(填操作序号)。
(2)原料粗盐中常含有泥沙和Ca2+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是_____(填序号)。
(3)若把U形管中的NaCl溶液换成100mL0.1mol/L的CuSO4溶液,且只进行操作②,则当电路中通过0.01mol电子时:(填“铁”或“石墨”)____电极增重_____g,此时溶液的pH=_____(忽略溶液体积变化)。
(4)若把U形管中的NaCl溶液换成加入了2molAgNO3、1molNa2SO4和1molBaCl2后的溶液,且只进行操作②,则装置中可观察到的现象为:____。通电一段时间后,氧化产物与还原产物的质量比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的镁粉和铝粉混合粉末加入过量的盐酸溶解后,再向所得溶液中加入氢氧化钠溶液,得到的沉淀的物质的量与加入氢氧化钠的物质的量关系如图所示。
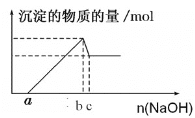
求:
⑴混合粉末中镁粉、铝粉各多少克______?
⑵加入盐酸的物质的量是多少______?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com