
【题目】已知NO2与以SO2能发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g)。
SO3(g)+NO(g)。
(1)上述反应涉及的四种氧化物中,_________(填化学式)属于酸性氧化物。
(2)已知:2NO(g)+O2(g)=2NO2(g)△H1=-113.0kJ·mol-1
2SO2(g)+O2(g) ![]() 2SO3(g)△H2=-196.6kJ·mol-1
2SO3(g)△H2=-196.6kJ·mol-1
则NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H=__________
SO3(g)+NO(g)△H=__________
(3)在一恒容密闭容器中,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。

① 当容器内____(填字母)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
a.气体的压强 b.气体的平均摩尔质量 c.气体的密度 d. NO2的体积分数
② 若A点对应的实验中,SO2(g)的起始浓度为c0mol/L,经过t min后反应达到平衡,则反应从起始至t min 内的化学反应速率v(NO2)=_____mol/(L·min)。
③ 若要使图中C点的平衡状态变为B 点的平衡状态,则应采取的措施是_________,若要使图中A点的平衡状态变为B 点的平衡状态,则应采取的措施是___________。
(4)将NO2与SO2的混合气体[n0(NO2):n0(SO2)=1]通入2mL0.1mol/L氯化钡溶液中,只生成一种白色沉淀物M,M的化学式为_______,当溶液中的Ba2+恰好完全沉淀(Ba2+的浓度等于1.0×10-5mol/L),通入的混合气体在标准状况下的体积约为______L。(M的Kap=1.0×10-9)
【答案】 SO3、SO2 -41.8KJ/mol d c0/5t 将NO2和SO2的物质的量之比调节为1:1 将NO2和SO2物质的量之比调节为1:1的同时降低温度 BaSO4 8.96×10-3
【解析】(1)本题考查物质的分类,酸性氧化物是与水反应生成相应的酸,且化合价不变化,或与碱反应生成盐和水, NO2与水反应:3NO2+H2O=2HNO3+NO,存在化合价变化,因此NO2不属于酸性氧化物,NO是不成盐氧化物,因此属于酸性氧化物的是SO2、SO3;(2)考查热化学反应方程式的计算,①2NO(g)+O2(g)=2NO2(g),②2SO2(g)+O2(g) ![]() 2SO3(g),(②-①)/2得出:△H=(-196.6+113.0)/2kJ·mol-1=-41.8kJ·mol-1;(3)本题考查化学反应速率的计算、化学平衡状态的判断、影响化学平衡移动的因素,①a、因为前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故a错误;b、根据M=m/n,组分都是气体,因此气体质量不变,反应前后气体系数之和相等,因此气体物质的量不变,即M不变,不能说明反应达到平衡,故b错误;c、根据ρ=m/V,组分都是气体,气体的质量不变,容器是恒容状态V不变,因此密度不变,不能说明反应达到平衡,故c错误;d、根据化学平衡状态的定义,当组分的浓度或体积分数不变,说明反应达到平衡,故d正确;②A点对应的n(NO2)/n(SO2)=0.4,起始时c(SO2)=c0mol·L-1,因为容器的体积不变,因此起始时c(NO2)=0.4c0mol·L-1,A点对应的NO2的转化率为50%,因此消耗的NO2的浓度为0.4c0×50%mol·L-1,依据化学反应速率的数学表达式,v(NO2)=0.4c0×50%/tmol/(L·min)=0.2c0/t mol/(L·min)或c0/5tmol/(L·min);③C点对应n(NO2)/n(SO2)=1.5,B点对应n(NO2)/n(SO2)=1,C点转化成B点,在C点增加SO2,调节到n(NO2)/n(SO2)=1,NO2的转化率增加,即C点的平衡状态变为B点平衡状态;A点对应n(NO2)/n(SO2)=0.4,A点转化成B点,需要减少SO2,达到n(NO2)/n(SO2)=1,此时平衡向逆反应方向进行,NO2的转化率降低,但维持NO2的转化率不变,因为正反应是放热反应,因此需要同时降低温度;(4)考查溶度积的计算,NO2与水反应:3NO2+H2O=2HNO3+NO,SO2具有还原性,因此有2H2O+2HNO3+3SO2=3H2SO4+2NO,然后发生BaCl2+H2SO4=BaSO4↓+2HCl,因此沉淀M是BaSO4,根据溶度积,求出溶液中c(SO42-),即c(SO42-)=Ksp/c(Ba2+)=1.0×10-9/1×10-5mol·L-1=1×10-4mol·L-1,因此溶液中n(SO42-)=2×10-3×10-4mol·L-1=2×10-7mol·L-1,Ba2+全部转化成沉淀,则BaSO4的物质的量为2×10-3×0.1mol=2×10-4mol,根据硫元素守恒,即SO2的物质的量为(2×10-4+2×10-7)mol≈2×10-4mol,n(NO2)/n(SO2)=1,则n(NO2)= 2×10-4mol,气体总物质的量为4×10 -3mol,气体体积为8.96×10-3L。
2SO3(g),(②-①)/2得出:△H=(-196.6+113.0)/2kJ·mol-1=-41.8kJ·mol-1;(3)本题考查化学反应速率的计算、化学平衡状态的判断、影响化学平衡移动的因素,①a、因为前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故a错误;b、根据M=m/n,组分都是气体,因此气体质量不变,反应前后气体系数之和相等,因此气体物质的量不变,即M不变,不能说明反应达到平衡,故b错误;c、根据ρ=m/V,组分都是气体,气体的质量不变,容器是恒容状态V不变,因此密度不变,不能说明反应达到平衡,故c错误;d、根据化学平衡状态的定义,当组分的浓度或体积分数不变,说明反应达到平衡,故d正确;②A点对应的n(NO2)/n(SO2)=0.4,起始时c(SO2)=c0mol·L-1,因为容器的体积不变,因此起始时c(NO2)=0.4c0mol·L-1,A点对应的NO2的转化率为50%,因此消耗的NO2的浓度为0.4c0×50%mol·L-1,依据化学反应速率的数学表达式,v(NO2)=0.4c0×50%/tmol/(L·min)=0.2c0/t mol/(L·min)或c0/5tmol/(L·min);③C点对应n(NO2)/n(SO2)=1.5,B点对应n(NO2)/n(SO2)=1,C点转化成B点,在C点增加SO2,调节到n(NO2)/n(SO2)=1,NO2的转化率增加,即C点的平衡状态变为B点平衡状态;A点对应n(NO2)/n(SO2)=0.4,A点转化成B点,需要减少SO2,达到n(NO2)/n(SO2)=1,此时平衡向逆反应方向进行,NO2的转化率降低,但维持NO2的转化率不变,因为正反应是放热反应,因此需要同时降低温度;(4)考查溶度积的计算,NO2与水反应:3NO2+H2O=2HNO3+NO,SO2具有还原性,因此有2H2O+2HNO3+3SO2=3H2SO4+2NO,然后发生BaCl2+H2SO4=BaSO4↓+2HCl,因此沉淀M是BaSO4,根据溶度积,求出溶液中c(SO42-),即c(SO42-)=Ksp/c(Ba2+)=1.0×10-9/1×10-5mol·L-1=1×10-4mol·L-1,因此溶液中n(SO42-)=2×10-3×10-4mol·L-1=2×10-7mol·L-1,Ba2+全部转化成沉淀,则BaSO4的物质的量为2×10-3×0.1mol=2×10-4mol,根据硫元素守恒,即SO2的物质的量为(2×10-4+2×10-7)mol≈2×10-4mol,n(NO2)/n(SO2)=1,则n(NO2)= 2×10-4mol,气体总物质的量为4×10 -3mol,气体体积为8.96×10-3L。


科目:高中化学 来源: 题型:
【题目】有机物F对花香和果香具有提升作用,故常用于化妆品工业和食品工业。有机物F可以用下面的设计方案合成。

请回答下列问题:
(1)写出A的结构简式:_________________。
(2)①的反应类型:_______________。
(3)写出反应③的化学方程式:_________________________________________。
(4)F的同分异构体中含有—COO—的一取代苯结构有多个。请写出其中能发生银镜反应的两种物质的结构简式______________、___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量 ;
②若B、C都不是气体,气体的平均相对分子质量 ;
③若B是气体,C不是气体,气体的平均相对分子质量 ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是 态,C是 态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于细胞中元素与分子的叙述中,正确的是
A. 微量元素不参与血红蛋白的构成
B. 组成拟核与磷脂的元素种类不同
C. DNA与三磷酸腺苷中的五碳糖不同
D. T2噬菌体的遗传信息贮存在于脱氧核苷酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能

A. CH3OH B. C3H8 C. C2H4 D. CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过CaCl2管(A)和碱石灰(B),测得A管质量增加了2.16 g,B管增加了9.24 g,已知该有机物的相对分子质量为108。
(1)求此有机物的分子式。
(2)该有机物1分子中有1个苯环,试写出它的同分异构体的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂。某课题组经查阅资料后设计合成铝氢化钠的简易流程如图所示。

已知:①AlCl3、NaH、NaAlH4遇水都能迅速发生反应。
②常温下,可用高锰酸钾、氯酸钾、重铬酸钾、次氯酸钙等与浓盐酸反应制取氯气。
(1)铝氢化钠遇水发生剧烈反应,甚至可能发生爆炸,其原因是_______________。写出铝氢化钠与水反应的化学方程式_____________________。
(2)甲同学设计实验制备无水氯化铝的装置如图所示。
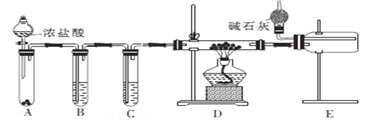
①装置E中干燥管的作用是_______________________。
②点燃装置D处酒精灯之前 需先排尽装置内的空气,其操作方法是________________。
(3)乙同学分析甲同学设计的装置后,认为只改变A、B、D中的试剂就可以用甲同学设计的装置制备NaH。
①试管B中的试剂改为____________________。
②若操作不当,则制得的NaH产品中可能含有的杂质有_________________。
(4)丙同学设计以下4种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。




从易操作性、准确性角度考虑,宜选装置________。铝氢化钠与水完全反应,冷却至室温的标志是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙烯和乙酸的结构与性质,推测CH2=CH—COOH能发生的反应有( )
①加成反应 ②取代反应 ③氧化反应
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
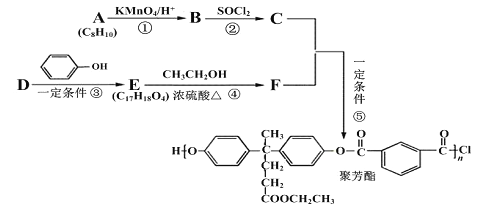
【题目】聚芳酯(PAR)在航空航天等领域具有广泛应用。下图是合成某聚芳酯的路线:
已知: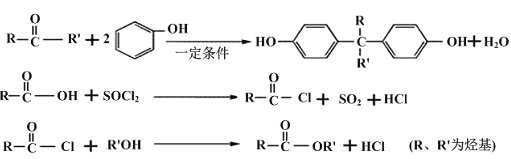
(1)A的名称为______________________,B的结构简式是_________________________。
(2)D的分子式为_______________________,反应④的反应类型是________________。
(3) 写出⑤的化学方程式为______________________________________________。
(4)M是符合下列条件的B的同分异构体
a.能发生银镜反应、水解反应,还能与Na2CO3溶液反应
b.苯环上只有两个取代基且无“—O—O—”结构
c.能与FeCl3发生显色反应
则M共有_______种;其中存在着含4种不同化学环境的氢的物质,写出其与Na2CO3溶液反应但不产生气体的化学方程式(任写一种) ____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com