
【题目】(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式____________________________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式_____________________________。
(3)断裂1 mol化学键所需的能量如表所示:
共价键 | H—N | H—O | N≡N | O==O |
断裂1 mol化学键所需能量/kJ | 393 | 463 | 941 | 496 |
计算1molN2(g)与H2O(g)反应生成NH3(g)和O2(g)的反应热△H = _______________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为________________。
【答案】 N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622kJ/mol 2NH3(g)+CO2(g)= CO(NH2)2(s) +H2O(l) △H=-87kJ/mol +617 kJ/mol 2NH3-6e-+6OH-= N2+6H2O
【解析】试题分析:本题考查反应热的计算,热化学方程式的书写,燃料电池电极反应式的书写。
(1)肼在O2中燃烧的化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l),n(N2H4)=![]() =0.25mol,则1mol肼燃烧放出155.5kJ
=0.25mol,则1mol肼燃烧放出155.5kJ![]() 0.25=622kJ热量,反应的热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622kJ/mol。
0.25=622kJ热量,反应的热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622kJ/mol。
(2)运用盖斯定律,将①式+②式-③式得,2NH3(g)+CO2(g)= CO(NH2)2(s) +H2O(l) △H=(-159.5kJ/mol)+(116.5kJ/mol)-(+44kJ/mol)=-87kJ/mol,CO2与NH3合成尿素和液态水的热化学方程式为2NH3(g)+CO2(g)= CO(NH2)2(s) +H2O(l) △H=-87kJ/mol。
(3)N2(g)与H2O(g)反应生成NH3(g)和O2(g)的方程式为2N2(g)+6H2O(g)=4NH3(g)+3O2(g),该反应的ΔH=反应物的键能总和-生成物的键能总和=2E(N![]() N)+12E(H-O)-12E(N-H)-3E(O=O)=2
N)+12E(H-O)-12E(N-H)-3E(O=O)=2![]() 941kJ/mol+12
941kJ/mol+12![]() 463kJ/mol-12
463kJ/mol-12![]() 393kJ/mol-3
393kJ/mol-3![]() 496kJ/mol=+1234kJ/mol,则1molN2(g)与H2O(g)反应生成NH3(g)和O2(g)的ΔH=+1234kJ/mol
496kJ/mol=+1234kJ/mol,则1molN2(g)与H2O(g)反应生成NH3(g)和O2(g)的ΔH=+1234kJ/mol![]() 2=+617kJ/mol。
2=+617kJ/mol。
(4)氨气在纯氧中燃烧,生成一种单质和水,反应的方程式为4NH3+3O2=2N2+6H2O,在此反应中NH3发生失电子的氧化反应,通入氨气的电极为负极,在碱性条件下发生反应的电极反应式为2NH3-6e-+6OH-= N2+6H2O。


科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( ) 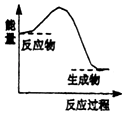
A.氢氧化钾与硫酸的反应
B.金属镁与盐酸的反应
C.高温条件下碳粉与二氧化碳的反应
D.Ba(OH)28H2O晶体与NH4Cl固体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙醇的说法正确的是( )
A.无水乙醇常用于医疗消毒
B.用乙醇作萃取剂可以将碘从碘水中萃取出来
C.乙醇、乙烷和苯都可以与钠反应生成氢气
D.乙醇是一种可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是( )
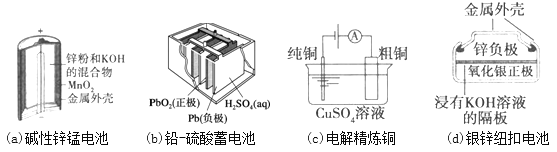
A. 图(a)所示电池中,MnO2的作用是催化剂
B. 图(b)所示电池放电过程中,硫酸浓度不断增大
C. 图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述中不正确的是
A. 甲烷分子为正四面体结构B. 甲烷的二氯代物只有1种
C. 甲烷不能使酸性高锰酸钾溶液褪色D. 甲烷能与溴水发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。

(1)实验时装置A需在60℃~100℃进行的原因是_________,控制所需温度的方法是________。
(2)装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___________。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_________________。
Ⅱ. 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是_______ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________.
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)=_______mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F六种物质的转化关系如图所示(反应条件和部分产物未标出) 
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A,D反应都有红棕色气体生成,则A为 , 反应④的化学方程式为 .
(2)若A为常见的金属单质,D,F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 .
(3)若A,D,F都是短周期非金属元素单质,且A,D所含元素同主族,A,F所含元素同周期,则反应①的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com