
【题目】Ⅰ.酸碱中和滴定曲线是以酸碱滴定过程中滴加碱(或酸)的量或中和百分数为横坐标,以溶液 pH 为纵坐标,绘出溶液 pH 随碱(或酸)的滴加量而变化的曲线。它描述了滴定过程中溶液 pH 的变化情况,特别是滴定终点附近溶液 pH 的突变情况。下图为某浓度的 NaOH 溶液滴定 10.00mL 一定浓度的盐酸的图像

根据图像分析计算:
(1)HCl 溶液的浓度是___________,NaOH 溶液的浓度是____________。
(2)若向 20mL 稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
A.  B.
B. 
C.  D.
D. 
Ⅱ.下图为水在 T1℃和 T2℃时(T1<T2)对应的电离平衡曲线,回答下列问题:

(1)在T2℃时,若10体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________________。
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液,若将二者等体积混合,混合溶液的pH>7,则BOH为_________碱,(填“强”或“弱”),判断的理由是_________。
(3)在曲线A所对应的温度下,向一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,所得混合液的pH=11,则两溶液的体积比V[Ba(OH)2]∶V(NaHSO4)=_________(假定混合液的总体积等于混合前两溶液体积之和)。
【答案】0.1000mol/L 0.05000mol/L B a+b=13 碱 若BOH是强碱,等体积混合时酸过量,此时pH<7 1:4
【解析】
Ⅰ.(1)由图可知,未滴定时,pH=1,说明盐酸中氢离子的浓度为0.1000mol/L;设该NaOH溶液的物质的量浓度分别为c(NaOH),当NaOH溶液体积为20mL,结合图象可以求解;
(2)稀氨水中,氨水电离生成铵根离子和氢氧根离子导致溶液中氢氧根离子浓度大于氢离子,所以氨水溶液呈碱性;盐酸溶液呈酸性,当向氨水溶液中加入盐酸时,盐酸和氨水发生酸碱中和反应导致溶液的pH值降低;当加入20mL盐酸时,盐酸和氨水的物质的量相等,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性;继续向溶液中加盐酸,盐酸过量,当盐酸的量远远大于氨水的物质的量时,溶液以盐酸为主,导致溶液的pH值近似于盐酸的pH值,图象中B符合;
Ⅱ.(1)升温促进水的电离,水的电离常数变大,故曲线A为T1,曲线B为T2;强酸的pH=a,强碱的pH=b,由T2℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,即n(H+)=n(OH);
(2)由于盐酸中c(H+)>碱BOH溶液中c(OH-),若BOH是强碱,等体积混合时酸过量,此时pH<7,则BOH是弱碱;
(3)pH=12的Ba(OH)2溶液中C(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol;反应的硫酸氢钠物质的量为0.5x×10-2mol;设硫酸氢钠溶液体积为y,依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=1,由此求解。
Ⅰ.(1)由图可知,未滴定时,pH=1,说明盐酸中氢离子的浓度为0.1000mol/L,即盐酸的浓度为0.1000mol/L;设该NaOH溶液的物质的量浓度分别为c(NaOH),当NaOH溶液体积为20mL,结合图象可知,溶液呈中性,恰好反应,即:10mL×0.1000mol/L=20c(NaOH),c(NaOH)=0.05000mol/L;
(2)稀氨水中,氨水电离生成铵根离子和氢氧根离子导致溶液中氢氧根离子浓度大于氢离子,所以氨水溶液呈碱性;盐酸溶液呈酸性,当向氨水溶液中加入盐酸时,盐酸和氨水发生酸碱中和反应导致溶液的pH值降低;当加入20mL盐酸时,盐酸和氨水的物质的量相等,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性;继续向溶液中加盐酸,盐酸过量,当盐酸的量远远大于氨水的物质的量时,溶液以盐酸为主,导致溶液的pH值近似于盐酸的pH值,图象中B符合;故选B;
Ⅱ.(1)升温促进水的电离,水的电离常数变大,故曲线A为T1,曲线B为T2;强酸的pH=a,强碱的pH=b,由T2℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,即n(H+)=n(OH),则10×10a=1×10b-12,101a=10b12,即1a=b12,则a+b=13,故答案为:a+b=13;
(2)由于盐酸中c(H+)>碱BOH溶液中c(OH-),若BOH是强碱,等体积混合时酸过量,此时pH<7,则BOH是弱碱;
(3)pH=12的Ba(OH)2溶液中C(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol;反应的硫酸氢钠物质的量为0.5x×10-2mol;设硫酸氢钠溶液体积为y,依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,计算得到溶液中氢氧根离子浓度为10-3mol/L;所以得到:![]() =10-3,得到x:y=1:4,则所加入的Ba(OH)2溶液与NaHSO4溶液体积之比是1:4。
=10-3,得到x:y=1:4,则所加入的Ba(OH)2溶液与NaHSO4溶液体积之比是1:4。


科目:高中化学 来源: 题型:
【题目】某有机物的蒸气跟足量O2混合点燃,充分反应后生成CO24.48L(已折算成标准状况)和5.4 g H2O。下列关于该有机物的说法正确的是
A.该有机物中肯定不含氧元素
B.分子中C、H、O个数比为1∶3∶1
C.若该有机物中含氧元素,则该有机物一定为乙醇
D.若该有机物的相对分子质量为30,则该有机物一定是乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子
等离子![]() 当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是![]()
![]()

A.原溶液中一定含有![]()
B.反应后最终溶液中的溶质只有![]()
C.原溶液中含有![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]()
D.原溶液中一定含有的阴离子是![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某固定容积密闭容器中,发生可逆反应:A(g)+B(g) ![]() xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ说法中正确的是(T 表示温度,P 表示压强,C%表示 C 的体积分数) ( )
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ说法中正确的是(T 表示温度,P 表示压强,C%表示 C 的体积分数) ( )

A.P3<P4,y 轴表示 C 的体积分数
B.P3<P4,y 轴表示混合气体的密度
C.P3>P4,y 轴表示 B 的百分含量
D.P3>P4,y 轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为 C(s)+2H2(g) ![]() CH4(g)。在VL 的容器中投入 amol 碳(足量),同时通入 2amolH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图所示。下列说法正确的是( )
CH4(g)。在VL 的容器中投入 amol 碳(足量),同时通入 2amolH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压强及温度的变化关系如图所示。下列说法正确的是( )

A.在 4MPa、1200K 时,图中 X 点 v 正(H2)<v 逆(H2)
B.在 5MPa、800K 时,该反应的平衡常数为![]()
C.上述正反应为吸热反应
D.工业上维持 6MPa、1000K 而不采用 10MPa、1000K,主要是因为前者碳的转化率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.某盐的水溶液呈酸性,该盐一定是强酸弱碱盐
B.中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同
C.水的离子积常数![]() 随着温度的升高而增大,说明水的电离过程是吸热的
随着温度的升高而增大,说明水的电离过程是吸热的
D.弱电解质溶液稀释后,溶液中各种离子浓度一定都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图象的解释或结论正确的是![]()
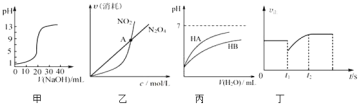
A.图甲表示用![]() 溶液滴定
溶液滴定![]()
![]()
![]() 醋酸溶液的滴定曲线
醋酸溶液的滴定曲线
B.由乙可知:对于恒温恒容条件下的反应![]() ,A点为平衡状态
,A点为平衡状态
C.由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D.图丁表示反应![]() ,
,![]() 时刻减小了压强
时刻减小了压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图像的说法中正确的是
A. 图① 表示可逆反应“CO(g)+H2O(g)
表示可逆反应“CO(g)+H2O(g)![]() CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B. 图② 以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
C. 图③ 表示碳酸钠溶液加水稀释时溶液的pH值变化
表示碳酸钠溶液加水稀释时溶液的pH值变化
D. 图④ 表示压强对可逆反应2A(g)+2B(g)
表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10-23:1
D.a点对应的Ksp大于b点对应的Ksp
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com