
����Ŀ���ۺ�����CO2��CO�Թ�����̼�������Ҫ���塣
��1��H2 ��CO�ϳɼ״���ӦΪ��CO��g��+2H2��g��![]() CH3OH��g�� ��H��0���ں��£����Ϊ2L���ܱ������зֱ����1.2mol CO��1mol H2��10min��ﵽƽ�⣬��ú���0.4mol CH3OH��g������ﵽƽ��ʱCO��Ũ��Ϊ_______��10min����H2��ʾ�Ļ�ѧ��Ӧ����Ϊ_______����Ҫ�ӿ�CH3OH���������ʲ����CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_______����һ�ֺ����Ĵ�ʩ����
CH3OH��g�� ��H��0���ں��£����Ϊ2L���ܱ������зֱ����1.2mol CO��1mol H2��10min��ﵽƽ�⣬��ú���0.4mol CH3OH��g������ﵽƽ��ʱCO��Ũ��Ϊ_______��10min����H2��ʾ�Ļ�ѧ��Ӧ����Ϊ_______����Ҫ�ӿ�CH3OH���������ʲ����CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_______����һ�ֺ����Ĵ�ʩ����
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK=________��
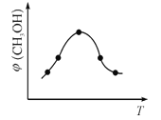
���ں����ܱ�������ʹCO2��H2�����ʵ���֮��Ϊ1��3��,����������Ӧ����Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ����ͼ��ʾ���� ��H _________0����������������С������
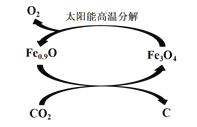
��3�� ����ͼ��ʾ������ȱ��������[��Fe0.9O]��ʵ��CO2���ۺ����á���˵����ת����2���ŵ�_____________������1 molȱ��������[Fe0.9O]������CO2��ȫ��Ӧ������________mol C(̼)��
���𰸡�0.4mol/L 0.04mol/��L.min�� ����ѹǿ������H2������ ![]() ���� ��CO2ת��ΪC��O2��������̫���ܣ�Fe3O4��ѭ��ʹ�� 0.1
���� ��CO2ת��ΪC��O2��������̫���ܣ�Fe3O4��ѭ��ʹ�� 0.1
��������
��1���������η����м��㣻
��2����ƽ�ⳣ��������������֮�����Է�Ӧ����֮�������ݷ���ʽд������ʽ��
�ڸ���ͼ���֪��ߵ㷴Ӧ�ﵽƽ��״̬���ﵽƽ��������¶ȣ���(CH3OH)��С���ɵ�ƽ�������ƶ���
��3����ͼ��֪��Fe0.9O���Խ�CO2ת��ΪFe3O4��C����Fe3O4����̫���ܸ��������·ֽ�ΪFe0.9O��O2���ݴ˷��������㡣
��1��������������ݿ�֪��
CO��g��+2H2��g��![]() CH3OH��g��
CH3OH��g��
ʼ��mol�� 1.2 1 0
ת��mol�� 0.4 0.8 0.4
ƽ��mol�� 0.8 0.2 0.4
�ﵽƽ��ʱ��c(CO)=![]() =0.4mol/L��
=0.4mol/L��
v(H2)=![]() =
=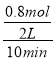 =0.04 mol/��L.min��;
=0.04 mol/��L.min��;
��Ҫ���CO��ת���ʣ���ʹƽ�������ƶ�������ѹǿ����Ӧ���ʼӿ죬ƽ�������ƶ�����
��2����ƽ�ⳣ��������������֮�����Է�Ӧ����֮����K=![]() ��
��
�ڸ���ͼ���֪��ߵ㷴Ӧ�ﵽƽ��״̬���ﵽƽ��������¶ȣ���(CH3OH)��С���ɵ�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����H<0��
��3����ͼ��֪��Fe0.9O���Խ�CO2ת��ΪFe3O4��C����Fe3O4����̫���ܸ��������·ֽ�ΪFe0.9O��O2��������������̫���ܣ�Fe3O4��ѭ��ʹ�ã����ܽ�CO2ת��ΪC��O2�������˻�����Ⱦ������ʽ��дΪ��Fe0.9O+0.1CO2=xC+![]() Fe3O4������̼ԭ���غ�ɵ�x=0.1mol��
Fe3O4������̼ԭ���غ�ɵ�x=0.1mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��Q��M������ԭ��������������Ķ���������Ԫ�أ�X��ԭ�Ӱ뾶��С��Ԫ�أ�Y����̬�⻯����ʹʪ��ĺ�ɫʯ����ֽ������Z�ĵ����ǿ�������Ҫ�ɷ�֮һ��R��Q��M����Ԫ�ص�����������Ӧ��ˮ�����֮����ɷ�Ӧ��M�ĵ����ǻ���ɫ���塣��ش��������⣺
��1��Z��M�ķǽ�����ǿ��Z_________M���<����>����=������
��2��Z��Q��M�����Ӱ뾶�ɴ�С��˳��Ϊ__________________�������ӷ��ű�ʾ����
��3��X��Z��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ��������ʽΪ___________��
��4��YԪ�ص���̬�⻯����������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽΪ______________�������ɵ�����ˮ��Һ������Ũ���ɴ�С��˳��Ϊ_______________��
��5��![]() ��һ�ָ�Ч��ȫ��ɱ�������������ܽ���Ʒ�ˮ�е�
��һ�ָ�Ч��ȫ��ɱ�������������ܽ���Ʒ�ˮ�е�![]() ����Ϊ�����������壬������ԭ����ͼ۵ļ����ӣ�д���÷�Ӧ�����ӷ���ʽ___________________________��
����Ϊ�����������壬������ԭ����ͼ۵ļ����ӣ�д���÷�Ӧ�����ӷ���ʽ___________________________��
��6���õ�ⷨ���Ʊ�![]() ������ܷ�ӦΪ
������ܷ�ӦΪ![]() ����֪��������Ϊ
����֪��������Ϊ![]() ����������ˮ��ˮ������
����������ˮ��ˮ������![]() ��
��![]() ����õ缫����
����õ缫����![]() �ĵ缫��ӦΪ________________��
�ĵ缫��ӦΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά���� C����������Ѫ�ᣬ����ʽΪ C6H8O6�����н�ǿ�Ļ�ԭ�ԣ������ڿ������ױ�������������������ͨ������������Һ������֪���ʵ���Ũ�ȵ� I2 ��Һ���вⶨ���÷�Ӧ �Ļ�ѧ����ʽ���£�C6H8O6+ I2 = C6H6O6 +2HI�������ⶨij��Ʒ��ά���� C �������� ��������IJ��輰��õ��������£�ȡ10mL6mol/LCH3COOH���ṩ���Ի�����������100 mL ����ˮ������Һ������к������ȴ����ȷ��ȡ 0.2000g ��Ʒ���ܽ���������ȴ�� ��Һ�У����������ʵ���Ũ��Ϊ 0.05000 mol/L �� I2 ��Һ���з�Ӧ���պ���ȫ��Ӧʱ������21.00 mL I2 ��Һ��
��1��CH3COOH ϡ��ҺҪ�Ⱦ���С���ȴ�����ʹ�ã���е���Ϊ�˸�����Һ����Һ�е�_____�������ʵĻ�ѧʽ��
��2����Ʒ��ά���� C ����������Ϊ______���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��Fe2O3��Al2O3��Ʒ�ܽ��ڹ�����200mL pH=1��������Һ�У�Ȼ�������м���NaOH ��ҺʹFe3+��Al3+�պ���ȫ��������ȥNaOH ��Һ100 mL,��NaOH ��Һ��Ũ��Ϊ
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B����������Ԫ����ɵĻ����A��ij��Ԫ�ص���������Ϊ75% ��B��һ�ֵ���ɫ���壬C��J��ͬ����Ԫ�ص���̬�⻯�����C�Ǻ�������ߵ�����XΪ��ɫҺ�塣��Ӧ���ɵ�ˮ������ȥ������������ͼ��ʾ�Ĺ�ϵ��

��1��д����ѧʽ��A___________B____________J_____________��
��2����Ӧ����ÿ����1molF��ת�Ƶ��ӵ���ĿΪ��___________��
��3����Ӧ�ܵĻ�ѧ����ʽΪ��________________________________________________��
��4�����ӷ���ʽ�ֱ�Ϊ����Ӧ��__________________________________________��
��__________________________________________________________��
��5����Ӧ���У�ÿ1.00gC��������F���ã��ָ���25��ų�55.6kJ������д����Ӧ�ٵ��Ȼ�ѧ����ʽ__________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����20mLcmol��L��1KOH��Һ�еμ�0.1mol��L��1HCOOH��Һ�������Һ��ˮ���������������Ũ����μӼ���(����)��Һ���(V)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
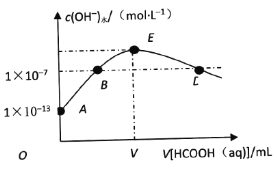
A. ����KOH��Һ��Ũ��c��0.01mol��L��1
B. B���Ӧ����Һ�У�c(K��)��c(HCOO��)
C. E���Ӧ����Һ�У�c(OH��)��c(H��)��c(HCOOH)
D. ��D���Ӧ�ļ�����Һ���ΪV1mL����HCOOH����ƽ�ⳣ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����50 mL 0.1 mol��L-1 NH4HSO4��Һ�еμ�0.05 mol��L-1 NaOH��Һ���õ���Һ��pH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ(����μӹ���������������)������˵����ȷ����

A��b����Һ������Ũ���ɴ�С��˳��Ϊ��c(Na+)��c(SO![]() )��c(NH
)��c(NH![]() )��c(H+)��c(OH-)
)��c(H+)��c(OH-)
B��ͼ��b��c��d������Һ��ˮ�ĵ���̶�������c��
C��b����μ�NaOH��Һ�����У�NH3��H2O�ĵ���̶���С
D��pH=7ʱ����Һ��c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з�Ӧ��
��Fe��CuSO4=Cu��FeSO4
��CaO��H2O=Ca(OH)2
��Ba(OH)2��H2SO4 =BaSO4����2H2O
��Zn��2HCl=ZnCl2��H2��
��2KClO3![]() 2KCl��3O2��
2KCl��3O2��
��CaCO3![]() CaO��CO2��
CaO��CO2��
��2CO��O2![]() 2CO2
2CO2
��SO42-��Ba2��=BaSO4��
��1����Ӧ���У���������______________________��
��2����Ӧ�۵����ӷ�Ӧ����ʽΪ_________________________________________��
��3��д��һ�����Ϣ�Ļ�ѧ��Ӧ����ʽ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeSO4��һ�־�ϸ������Ʒ������������ȱ����ƶѪ���Ƹľ�ķ����ȡ��Ʊ����裺����3mol��L-1�������������ȣ�����ʹ���ַ�Ӧ�������ȹ��ˣ�����50�������������ᾧ���õ����塪���̷���FeSO4��7H2O�����ش��������⣺
��1���Ʊ�FeSO4��Һʱһ�㲻�ý�Ũ�������3mol��L-1�����ԭ����___________����ӦʱҪ�����۹�����������__________��
��2�����鲽����������Һ�н��������ӵķ�����_________��
��3�����������ȹ��˵�ԭ����__________��
��4���ڿ����м����̷��������������¶ȱ仯��������ͼ��
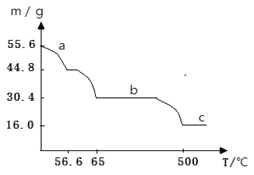
a���߶�Ӧ�ķ�Ӧ��ѧ����ʽΪ____________��
c���߶�Ӧ�����ʻ�ѧʽΪ_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com