
【题目】FeSO4是一种精细化工产品,可用于治疗缺铁性贫血、制革、木材防腐等。制备步骤:①将3mol·L-1硫酸加入铁粉里,微热,搅拌使其充分反应;②趁热过滤;③在50℃左右蒸发、结晶,得到晶体——绿矾(FeSO4·7H2O)。回答下列问题:
(1)制备FeSO4溶液时一般不用较浓硫酸而用3mol·L-1硫酸的原因是___________,反应时要求铁粉过量的理由是__________。
(2)检验步骤①所得溶液中金属阳离子的方法是_________。
(3)步骤②趁热过滤的原因是__________。
(4)在空气中加热绿矾,固体质量与温度变化曲线如下图:
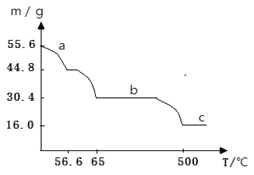
a曲线对应的反应化学方程式为____________。
c曲线对应的物质化学式为_________。
【答案】产生SO2,污染环境 防止生成Fe3+ 取少量待测液于试管中,加入KSCN溶液,无明显变化,再滴加少量氯水溶液变红色(或用NaOH溶液或K3[Fe(CN)6]溶液检验,叙述合理均可得分) 防止硫酸亚铁结晶析出造成损失 FeSO4·7H2O![]() FeSO4·4H2O+3H2O Fe2O3
FeSO4·4H2O+3H2O Fe2O3
【解析】
(1)制备FeSO4溶液时一般不用较浓硫酸而用3mol·L-1硫酸的原因是浓硫酸有强的氧化性,与铁发生反应,会产生SO2气体,污染环境;反应时要求铁粉过量是由于若铁不足量,反应产生的Fe2+容易被氧化产生Fe3+,Fe过量,产生的Fe3+与过量的Fe发生反应又转化为Fe2+;
(2)检验步骤①所得溶液中金属阳离子Fe2+的方法是取少量待测液于试管中,加入KSCN溶液,无明显变化,再滴加少量氯水溶液变红色;或加入NaOH溶液产生白色沉淀,沉淀会迅速变为灰绿色,最后变为红褐色;
(3)FeSO4在水中的溶解度随温度的变化而变化较大,步骤②趁热过滤就可以防止硫酸亚铁结晶析出造成损失;
(4)55.6g绿矾的物质的量是n(FeSO4·7H2O)= 55.6g÷278g/mol=0.2mol,其中含有结晶水的质量是0.2mol×7×18g/mol=25.2g,在a段减少的质量是55.6g-44.8g=10.8g,小于25.2g,说明失去的是结晶水,其物质的量是n(H2O)= 10.8g÷18g/mol=0.6mol,即1mol盐失去3mol结晶水,所以得到的物质化学式是FeSO4·4H2O,分解反应方程式是FeSO4·7H2O![]() FeSO4·4H2O+3H2O;在0.2mol盐中含有铁元素的质量是m(Fe)= 0.2mol×56g/mol=11.2g,而在c曲线对应的物质的质量是16.0g,则含有氧元素的质量是16.0g-11.2g=4.8g,其物质的量是n(O)=4.8g÷16g/mol=0.3mol,n(Fe):n(O)=0.2mol:0.3mol=2:3,因此物质的化学式是Fe2O3。
FeSO4·4H2O+3H2O;在0.2mol盐中含有铁元素的质量是m(Fe)= 0.2mol×56g/mol=11.2g,而在c曲线对应的物质的质量是16.0g,则含有氧元素的质量是16.0g-11.2g=4.8g,其物质的量是n(O)=4.8g÷16g/mol=0.3mol,n(Fe):n(O)=0.2mol:0.3mol=2:3,因此物质的化学式是Fe2O3。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)H2 和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。
CH3OH(g) ΔH<0。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g) ΔH
CH3OH(g) +H2O(g) ΔH
①该反应的平衡常数表达式为K=________。
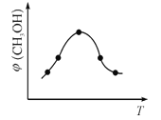
②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3),发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则 ΔH _________0(填“大于”或“小于”)
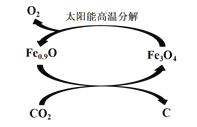
(3) 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用。请说明该转化的2个优点_____________。若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧充入1 mol N2,右侧充入CO和CO2的混合气体共8 g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是
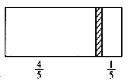
A. 右侧CO与CO2分子数之比为1∶3
B. 右侧气体密度是相同条件下氢气密度的18倍
C. 右侧CO的质量为1.75 g
D. 若隔板处于距离右端1/6处,其他条件不变,则前后两次压强之比为25∶24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(1)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为________mL,如果实验室有15 mL、20 mL、50 mL 量筒,应最好选用________量筒。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是________
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②可以长期贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是________(填字母)。
A.①②③④ B.②③ C.①③④ D.②③④
(4)下面操作造成所配稀硫酸溶液浓度偏高的是 ________ (填序号)。
A.浓硫酸稀释后溶液没有冷却到室温就转移 B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶
E.用量筒量取浓硫酸时仰视刻度线
F.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是___________(填氧化剂、还原剂)
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:__________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为__________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是______。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c=__________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是常见有机物的表示方法:
①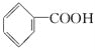 ②
②![]() ③CH4
③CH4
④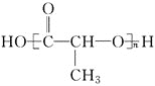 ⑤
⑤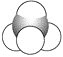
⑥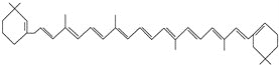
⑦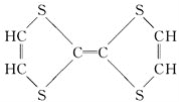
⑧ ⑨
⑨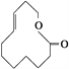
⑩
(1)上述表示方法中属于结构简式的为__________;
属于结构式的为________;
属于键线式的为________;
属于比例模型的为________;
属于球棍模型的为________。
(2)写出⑨的分子式:________。
(3)写出⑩中官能团的电子式:________、________。
(4)②的分子式为________,最简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出化学方程式
(1)硫在氧气中燃烧的化学方程式____
(2)碳粉和氧气的化学反应方程式____
(3)水蒸气与灼热的炭发生氧化还原反应的化学方程式____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于化合反应,又属于氧化还原反应的是( )
A.Fe+2HCl=H2↑+FeCl2B.2FeCl2+Cl2=2FeCl3
C.CaO+H2O=Ca(OH)2D.2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将![]() 溶液和
溶液和![]() 溶液等体积混合得到浊液;②取少量①中浊液,滴加
溶液等体积混合得到浊液;②取少量①中浊液,滴加![]() 溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加
溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加![]() 溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
A. 将①中浊液过滤,所得滤液中含少量![]()
B. ①中浊液存在平衡:![]()
C. ②中沉淀颜色变化说明![]() 转化为
转化为![]()
D. ③可以证明![]() ,比
,比![]() 更难溶
更难溶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com