
【题目】使用胆矾(CuSO4·5H2O)配制0.1 molL-1的硫酸铜溶液,正确的操作是
A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水中
B.称取25 g胆矾溶于水,然后将此溶液稀释至1 L
C.称取25 g胆矾溶解在1 L水里
D.将16 g胆矾溶于水,然后将此溶液稀释至1 L
【答案】B
【解析】
A. 将胆矾加热除去结晶水后得到硫酸铜,16g硫酸铜的物质的量为![]() =0.1mol,0.1mol硫酸铜溶于1L水中,所得溶液的体积不是1L,A错误;
=0.1mol,0.1mol硫酸铜溶于1L水中,所得溶液的体积不是1L,A错误;
B. 配制1L0.1mol/L的硫酸铜溶液需胆矾的质量为1L×0.1mol/L×250g/mol=25.0g,溶于水,将所得溶液恢复到室温,再转移至1000mL容量瓶中,洗涤并转移,定容,可得0.1mol/L的硫酸铜溶液,B正确;
C. 25 g胆矾中硫酸铜的物质的量为![]() =0.1mol,0.1mol硫酸铜溶于1L水中,所得溶液的体积不是1L,C错误;
=0.1mol,0.1mol硫酸铜溶于1L水中,所得溶液的体积不是1L,C错误;
D. 16 g胆矾中硫酸铜的物质的量不是0.1mol,应称取25g胆矾,D错误;
故选B。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是(Pb相对原子质量207)

A. 正极反应式:Ca+2Cl--2e-=CaCl2
B. 放电过程中,Li+向负极移动
C. 每转移0.1mol电子,理论上生成20.7gPb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,可以证明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1个N≡N键断裂的同时有3个H—H键形成
②N2、H2、NH3的分子数之比为1∶3∶2
③1个N≡N键断裂的同时有6个N—H键形成
④N2、H2、NH3的浓度不再变化
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室在配制Cu(NO3)2的溶液时,常将Cu(NO3)2固体先溶于较浓的硝酸中,再用蒸馏水稀释到所需的浓度,其目的是_________
(2)FeCl3净水的原理是(用离子方程式表示)_________将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______(写化学式)
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)____c(H2C2O4) (填“大于”或“小于”或“等于”)
(4)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示)______ ;灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是(用离子方程式表示)_______,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到已二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )。

A. 常温下Ka1(H2X)的值约为10-4.4
B. 曲线N表示pH与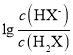
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据课本实验设计的一个能说明Na2CO3与NaHCO3热稳定性的套管实验。请观察下图的实验装置、分析实验原理,下列说法错误的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明NaHCO3受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊
D. 同质量的甲和乙分别与足量的盐酸完全反应,产生二氧化碳的质量:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:HCl>HI
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si

D.用中文“![]() ”
”![]() 命名的第118号元素在周期表中位于第七周期
命名的第118号元素在周期表中位于第七周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

请回答:
(1写出甲池中正极的电极反应式:______________________;负极的电极反应式:______________________。
(2乙池中负极是_______;正极是_______。
(3)由此实验,可得到如下哪些正确结论?_______(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )

A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com