
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
分析 (1)氯水中存在次氯酸的电离和水的电离两种电离平衡;向氯水中通入SO2,二者反应生成硫酸和盐酸,其漂白性减弱;当氯水饱和时再通氯气,c(H+)/c(ClO-)不变,若氯水不饱和再通氯气酸性增强会抑制次氯酸的电离,故比值增大;加水稀释氯水,溶液中的OH-浓度增大;加水稀释氯水,酸性减弱,对水的电离抑制作用减弱,故水的电离平衡向正反应方向移动;向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推导出:c(Na+)=c(Cl-)+c(ClO-).
(2)工业用电解饱和食盐水的方法制备氯气,反应的方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑,当阴极产生标准状况下11.2mL气体,即生成0.0005mol氢气,根据方程式计算生成NaOH的物质的量,进而计算溶液的pH;
(3)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠;
(4)继续滴加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸,若用双氧水氧化试管中制得的无色水溶液是过氧化氢氧化碘离子生成碘单质.
解答 解:(1)a.氯水中存在次氯酸的电离和水的电离两种电离平衡,故a正确;
b.向氯水中通入SO2,二者反应生成硫酸和盐酸,其漂白性减弱,故b错误;
c.当氯水饱和时再通氯气,c(H+)/c(ClO-)不变,若氯水不饱和再通氯气酸性增强会抑制次氯酸的电离,故比值增大,故c错误;
d.加水稀释氯水,溶液中的OH-浓度增大,故d错误;
e.加水稀释氯水,酸性减弱,对水的电离抑制作用减弱,故水的电离平衡向正反应方向移动,故e正确;
f.向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推导出:c(Na+)=c(Cl-)+c(ClO-),故f正确;
故答案为:aef;
(2)工业用电解饱和食盐水的方法制备氯气,反应的方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑,当阴极产生标准状况下11.2mL气体,即生成0.0005mol氢气,则生成NaOH0.001mol,c(OH-)=$\frac{0.001mol}{0.1L}$=0.01mol/L,则pH=12,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;12;
(3)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠,
方程式为NaClO+CO2+H2O═HClO+NaHCO3,生成的HClO不稳定,见光分解:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,ClO-与Cl-在酸性条件下发生氧化还原反应生成,离子方程式为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:NaClO+CO2+H2O═HClO+NaHCO3;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(4)继续滴加氯水后蓝色溶液又褪为无色,是由于氯气具有强氧化性,可与碘发生氧化还原反应生成盐酸和碘酸,方程式为5Cl2+I2+6H2O═2HIO3+10HCl,
若用双氧水氧化试管中制得的无色水溶液,是过氧化氢氧化碘离子生成碘单质,次氯酸和氯离子在酸性溶液中反应生成氯气,反应的离子方程式为:H2O2+2I-+2H+=I2+2H2O,
故答案为:5Cl2,I2,6H2O,2.,10HCl;H2O2+2I-+2H+=I2+2H2O.
点评 本题综合考查氯气和氯水的性质,题目较为综合,题目难度中等,注意把握题给信息,根据反应的现象判断生成物进而书写相关反应的方程式.


科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③④⑤ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 正、逆反应速率都为零 | D. | 反应体系中混合物的组成保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
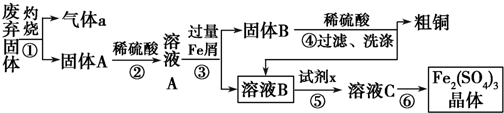
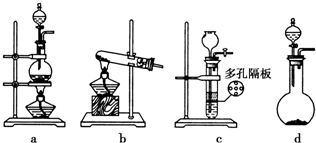
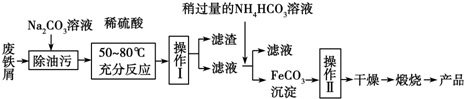
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A酸比B酸的电离程度小 | |
| B. | A是强酸,B是弱酸 | |
| C. | pH=1时,B酸的物质的量浓度比A酸大 | |
| D. | 将pH=1的A酸和B酸稀释成pH=5的溶液,A酸所需加入的水量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,生成物的总能量大于反应物的总能量 | |
| B. | 该反应中,断裂化学键会放出能量 | |
| C. | 乙醇的燃烧热为683.4KJ/mol | |
| D. | 反应$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(g)△H>-683.4KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com