
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
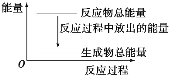
A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列说法正确的是
Na2S+2CO2↑。下列说法正确的是
A.4.2g14C原子含中子数目为1.8NA
B.1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C.该反应中,若生成1mol氧化产物,转移电子数目为4NA
D.常温下2.24LCO2中共用电子对数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气及硝酸工业废气中氮氧化物的处理是治理环境污染的重要课题。
(1)汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应I:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H1
N2(g)+2CO2(g)△H1
反应II:N2(g)+O2(g)![]() 2NO(g)△H2=+180.5kJ·mol-1
2NO(g)△H2=+180.5kJ·mol-1
已知CO的燃烧热为283.0kJ·mol-1,则△H1=________________。
(2)某研究小组探究催化剂对上述反应I的影响。将NO和CO混合气体以定的流速分别通过两种不同的催化剂a和b进行反应,在相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),得到图1中a、b两条曲线。温度低于200℃时,图1中曲线a脱氮率随温度升高而变化不大的主要原因为________________;m点________________(填“是”或者“不是”)对应温度下的平衡脱氮率,说明理由________________。
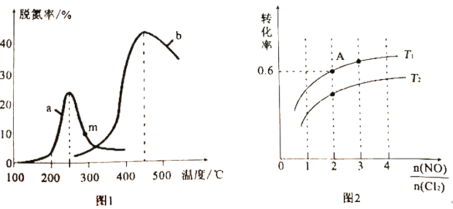
(3)一定条件下Cl2也可以与NO反应,生成一种有机合成中的重要试剂亚硝酰氯(NOCl),化学方程式为:2NO(g)+Cl2(g)![]() 2NOCl(g)△H<0。在恒温恒容条件下,将物质的量之和为3mol的NO(g)和Cl2(g)以不同的氮氯比[
2NOCl(g)△H<0。在恒温恒容条件下,将物质的量之和为3mol的NO(g)和Cl2(g)以不同的氮氯比[![]() ]通入容器中进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图2所示。
]通入容器中进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图2所示。
①图2中T1、T2的关系为T1________________T2(填“>”“<”或“=”)。
②图2中纵坐标为反应物________________的转化率,理由为________________。
③若在温度为T1,容积为1L恒容密闭的容器中反应,经过10min到达A点,则0~10min内反应速率v(NO)=________________mol·L-1·min-1。
④已知:用气体分压替代浓度计算的平衡常数叫压强平衡常数(Kp);分压=总压×气体物质的量分数。若该反应的起始压强为P0kPa,T1温度下该反应的压强平衡常数(Kp)为________________(用含P0的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、硝(P)、砷(As)等第VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)基态砷原子的价电子排布图为________________,第三周期元素的原子中,第一电离能大于磷原子的有________________种。
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有________________(填序号)。
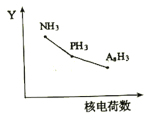
A.稳定性B.沸点时C.R-H键之间的键角D.分子间作用力E.还原性
(3)经测定发现,某种N2O5固体由NO2+和NO3-两种离子组成,阳离子中N原子的杂化方式是________________杂化,阴离子的空间构型为________________。
(4)乙二胺(H2N-CH2-CH2-NH2)与CuCl2溶液可形成配离子(结构如图)。
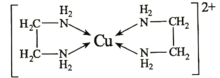
Cu2+的配位数为________________,1mol该配离子中含σ键为________________mol,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是________________。
(5)通常认为Cu3N是离子晶体,其晶格能可通过图1的Born-Haber循环计算得到。通过图1中数据________________(填“能”或“不能”)计算出Cu原子的第一电离能,Cu3N晶格能为________________kJ·mol-1。
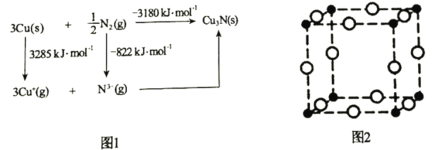
(6)Cu3N晶胞如图2所示,Cu+的半径为apm,N3-的半径为bpm,Cu3N晶胞的密度为________________g·cm-3(列出计算式即可,阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。
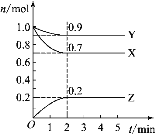
(1)由图中数据分析,该反应的化学方程式_____________。
(2)从反应开始至2 min,Z的平均反应速率为________。
(3)第5 min时,Z的生成速率________(填“大于”“小于”或“等于”)Z的消耗速率。
(4)第_______分钟时,反应达到平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。请写出②中反应的化学方程式______。
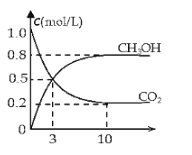
(2)如将CO2与H2以1:3的体积比混合,在适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,v(H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施有______。(只写一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液中或熔融状态下可以导电的化合物称为电解质 | CH3COOH水溶液中存在:CH3COOH |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 | H2O既是酸又是碱 |
C | Fe3Cl8可以改写为FeCl2·2FeC13 | Fe3I8可以改写为FeI·2FeI3 |
D | HCl在一定条件下能被MnO2氧化为Cl2 | HBr在一定条件下也能被MnO2氧化为Br2 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com