
【题目】氮(N)、硝(P)、砷(As)等第VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)基态砷原子的价电子排布图为________________,第三周期元素的原子中,第一电离能大于磷原子的有________________种。
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有________________(填序号)。
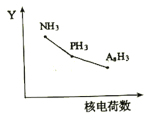
A.稳定性B.沸点时C.R-H键之间的键角D.分子间作用力E.还原性
(3)经测定发现,某种N2O5固体由NO2+和NO3-两种离子组成,阳离子中N原子的杂化方式是________________杂化,阴离子的空间构型为________________。
(4)乙二胺(H2N-CH2-CH2-NH2)与CuCl2溶液可形成配离子(结构如图)。
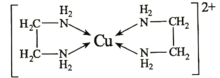
Cu2+的配位数为________________,1mol该配离子中含σ键为________________mol,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是________________。
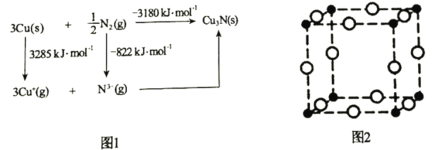
(5)通常认为Cu3N是离子晶体,其晶格能可通过图1的Born-Haber循环计算得到。通过图1中数据________________(填“能”或“不能”)计算出Cu原子的第一电离能,Cu3N晶格能为________________kJ·mol-1。
(6)Cu3N晶胞如图2所示,Cu+的半径为apm,N3-的半径为bpm,Cu3N晶胞的密度为________________g·cm-3(列出计算式即可,阿伏加德罗常数的值用NA表示)。
【答案】 2 AC sp 平面正三角形 4 26 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键 不能 5643
2 AC sp 平面正三角形 4 26 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键 不能 5643 ![]()
【解析】
(1)根据基态电子排布规律,As原子的基态电子排布式为:1s22s22p63s23p63d104s24p3,其价层电子排布式为:4s24p3,则基态砷原子的价电子排布图为 ;同周期元素第一电离能从左至右有逐渐增大的趋势,磷原子的基态电子排布式为:1s22s22p63s23p3,最外层电子3p轨道电子处于半满较稳定状态,第一电离能比同周期相邻的Si和S元素的大,第三周期元素的原子中,第一电离能最大的为零族元素Ar,则第一电离能大于磷原子的有Cl和Ar两种元素;
;同周期元素第一电离能从左至右有逐渐增大的趋势,磷原子的基态电子排布式为:1s22s22p63s23p3,最外层电子3p轨道电子处于半满较稳定状态,第一电离能比同周期相邻的Si和S元素的大,第三周期元素的原子中,第一电离能最大的为零族元素Ar,则第一电离能大于磷原子的有Cl和Ar两种元素;
(2)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,故A正确;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高,与图像不符,故B错误;
C.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,元素的电负性越强,电负性大的使电子对之间的斥力变大,键角越大,N、P、As电负性逐渐减小,R-H键之间的键角也逐渐减小,与图像相符,故C正确;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,与图像不符,故D错误;
E.氢化物的还原性,主要比较阴离子的还原性,N、P、As位于周期表同一主族,从上到下非金属性减弱,元素的非金属性越强,其单质的氧化性越强,对应阴离子的还原性越弱,则氢化物的还原性越弱,与图像不符,故E错误;
答案选AC;
(3)NO2+中N原子价层电子对个数=2+![]() =2、NO3-中N原子价层电子对个数=3+
=2、NO3-中N原子价层电子对个数=3+![]() =3,根据价层电子对互斥理论判断,阳离子中N原子的杂化方式是sp,阴离子中N原子的杂化方式是sp2,空间构型为平面正三角形;
=3,根据价层电子对互斥理论判断,阳离子中N原子的杂化方式是sp,阴离子中N原子的杂化方式是sp2,空间构型为平面正三角形;
(4)根据图示,Cu2+与4个N原子形成配位键,则Cu2+的配位数为4;配位键和单键都是σ键,该配离子中含有4个配位键和22个单键,则1mol该该配离子含σ键为26mol;乙二胺分子之间形成氢键,三甲胺分子之间不能形成氢键,乙二胺比三甲胺的沸点高的多;
(5)Cu原子的第一电离能为Cu(g)原子失去1个电子形成Cu+(g)所需要的能量,图示中只给出了固态铜原子失去电子的能量,铜原子由固态变为气态也有能量变化,图示中没有给出,故不能计算出Cu原子的第一电离能;Cu3N晶格能是Cu+、N3气态离子形成1molCu3N晶体释放的能量,设Cu3N的晶格能为akJmol1,根据盖斯定律,则:3285kJ/mol822kJ/molakJ/mol=3180kJ/mol,解得a=5643;
(6)由晶胞结构,白色球位于晶胞棱心,个数为![]() ×12=3,黑色球位于晶胞的顶点,个数为
×12=3,黑色球位于晶胞的顶点,个数为![]() ×8=1,白色球与黑色球个数比为3:1,可知顶点黑色球是N3,棱中心白色球是Cu+,结合图示,晶胞的边长为黑色球与白色球直径之和,已知:Cu+的半径为apm,N3-的半径为bpm,则晶胞的边长=2×(a+b)pm=2×(a+b)×10-10 cm,则立方体晶胞的体积V=8×(a+b)3×10-30 cm3,故Cu3N晶胞的密度=
×8=1,白色球与黑色球个数比为3:1,可知顶点黑色球是N3,棱中心白色球是Cu+,结合图示,晶胞的边长为黑色球与白色球直径之和,已知:Cu+的半径为apm,N3-的半径为bpm,则晶胞的边长=2×(a+b)pm=2×(a+b)×10-10 cm,则立方体晶胞的体积V=8×(a+b)3×10-30 cm3,故Cu3N晶胞的密度= =
=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】NaBH4是一种常见的还原剂。一种以H2、Na、硼酸三甲酯[B(OCH3)3]为原料,生产NaBH4的工艺流程如下:
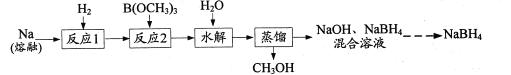
(1)下列措施能提高“反应1”的化学反应速率的有______(填字母)。
A.充分搅拌熔融钠
B.将熔融钠充分分散在石蜡油中
C.反应前排尽装置中的空气
(2)在浓硫酸作用下,B(OCH3)3可由B(OH)3和CH3OH发生酯化反应制得。浓H2SO4的作用是_____。
(3)“反应2”在240℃条件下进行,生成的产物是NaBH4和CH3ONa,写出该反应的化学方程式:____ 。“反应2”所用B(OCH3)3需充分干燥,原因是______。
(4)反应NaBH4+2H2O=NaBO2+4H2 可用于制取H2。一定浓度的NaBH4催化制氢的半衰期(溶液中NaBH4消耗一半时所需的时间)与溶液pH的关系如图所示:
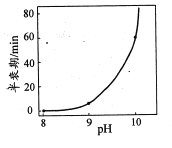
①NaBH4与水反应所得溶液呈碱性,原因是____。
②随着反应的进行,生成H2的速率逐渐减慢,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害,其在酸性条件下会产生NO和NO2。下列有关说法错误的是
A. NaNO2既可以使酸性高锰酸钾溶液褪色,又可以将二价铁离子氧化为三价铁离子
B. 食用“醋熘豆芽”可能会减少亚硝酸钠对人体的危害
C. NaNO2和胃酸作用的离子方程式为2NO2-+2H+![]() NO↑+NO2↑+H2O
NO↑+NO2↑+H2O
D. 1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡_________________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II. CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为____________。
(4)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。

a.增大CO浓度
b.加压
c.恒容时充入氩气
d.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
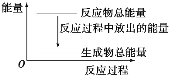
A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为
A. 32 g B. 48 g C. 64 g D. 96 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com