
【题目】化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑.为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘.请你了解情况,参与交流讨论.
[查阅资料]①常温下0.1molL﹣1的H2SO3溶液的pH约为2.1.
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1molL﹣1的H2S溶液的pH约为4.5.
[实验操作]①准确称取纯净的Na2SO37H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重(只有硫元素的化合价变化成最高价和最低价),质量为12.60g.
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异.将其溶于水得250mL溶液,测得pH=10.3.
[分析猜想]Na2SO37H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中除坩埚、酒精灯、三角架及隔绝空气的设备外,还需要的仪器有 .
(2)给Na2SO37H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明. .
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是 .
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是 . 实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示) .
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证.请简单叙述实验步骤、现象和结论. .
【答案】
(1)坩埚钳、泥三角
(2)避免Na2SO3被空气中氧气氧化,2Na2SO3+O2=2Na2SO4
(3)4Na2SO3 ![]() Na2S+3Na2SO4
Na2S+3Na2SO4
(4)实验③的溶液中可能有Na2S,相同条件下,S2﹣水解程度大于SO32﹣ , 溶液的碱性强;S2﹣+H2O?HS﹣+OH﹣
(5)取③溶液适量于试管中,向其中加稀H2SO4 , 如有腐蛋气味气体生成,则证明有S2﹣;另取③中溶液适量于试管中,加入HCl酸化的BaCl2 , 如有白色沉淀生成,证明有SO42﹣
【解析】解:(1)实验操作②中除坩埚、酒精灯、三角架及隔绝空气的设备外,还需要的仪器有泥三角、坩埚钳,所以答案是:泥三角、坩埚钳;(2)亚硫酸钠具有强的还原性,Na2SO37H2O加热时要隔绝空气,防止亚硫酸钠被氧气氧化为硫酸钠,即2Na2SO3+O2=2Na2SO4;
所以答案是:避免Na2SO3被空气中氧气氧化,2Na2SO3+O2=2Na2SO4;(3)Na2SO3在高温强热下发生分解反应是一个自身氧化还原反应,会生成﹣2价硫和+6价的硫,反应为:4Na2SO3 ![]() Na2S+3Na2SO4 ,
Na2S+3Na2SO4 ,
所以答案是:4Na2SO3 ![]() Na2S+3Na2SO4;(4)硫离子和亚硫酸根离子均能发生水解使得溶液显碱性,实验①和③中,两次测得的溶液pH相差明显,是因为二者的水解程度不一样而导致碱性强弱不一样,实验③中溶液的pH=10.3的原理是S2﹣+H2OHS﹣+OH﹣ ,
Na2S+3Na2SO4;(4)硫离子和亚硫酸根离子均能发生水解使得溶液显碱性,实验①和③中,两次测得的溶液pH相差明显,是因为二者的水解程度不一样而导致碱性强弱不一样,实验③中溶液的pH=10.3的原理是S2﹣+H2OHS﹣+OH﹣ ,
所以答案是:实验③的溶液中可能有Na2S,相同条件下,S2﹣水解程度大于SO32﹣ , 溶液的碱性强;S2﹣+H2OHS﹣+OH﹣;(5)硫离子能和酸反应生成硫化氢,硫离子的检验方法:取③溶液适量于试管中,向其中加稀H2SO4 , 如有腐蛋气味气体生成,则证明有S2﹣ , 硫酸根离子可以和钡离子反应生成硫酸钡,硫酸根离子的检验方法:另取③中溶液适量于试管中,加入HCl酸化的BaCl2 , 如有白色沉淀生成,证明有SO42﹣ ,
所以答案是:取③溶液适量于试管中,向其中加稀H2SO4 , 如有腐蛋气味气体生成,则证明有S2﹣;另取③中溶液适量于试管中,加入HCl酸化的BaCl2 , 如有白色沉淀生成,证明有SO42﹣ .


科目:高中化学 来源: 题型:
【题目】关于元素周期表,下列叙述中不正确的是 ( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C. 在非金属元素区域可以寻找制备新型农药材料的元素
D. 在地球上元素的分布和它们在元素周期表中的位置有密切关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与铝的混合物m g投入到n g水中,待反应停止后剩余固体a g。则过滤后所得滤液中的溶质是( )
A. NaOH B. NaOH和NaAlO2 C. NaAlO2 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHCO3 和 NaHSO4 溶液混合后,实际参加反应的离子是( )
A.CO32﹣ 和 H+B.HCO3﹣ 和HSO4﹣
C.CO32﹣ 和HSO4﹣D.HCO3﹣ 和 H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题: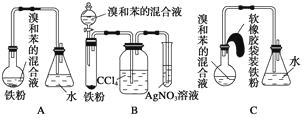
(1)写出三个装置中所共同发生的两个反应的化学方程式:;。
写出B中盛有AgNO3溶液的试管中所发生反应的化学方程式:。
(2)装置A和C均采用了长玻璃导管,其作用是。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是;
应对装置C进行的操作是。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是。
(5)B中采用了洗气瓶吸收装置,其作用是 , 反应后洗气瓶中可能出现的现象是。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m:n
B.25℃时,1kg气体A与1kg气体B的分子数之比为n:m
C.同温同压下,气体A与气体B的密度之比为m:n
D.标准状况下,等质量的A与B的体积比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏伽德罗常数,下列说法正确的是( )
A.相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B.56gFe与足量盐酸反应转移电子数为3NA
C.任何条件下,22.4LNH3与18gH2O所含电子数均为10NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取七水合硫酸亚铁(FeSO47H2O),设计了如图流程:下列说法不正确的是( ) 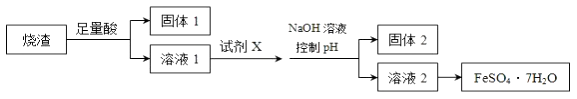
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH为使Al3+转化为Al(OH)3 , 进入固体2
C.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com