
【题目】现用0.1 mol/L的AlCl3溶液和0.1 mol/L的氢氧化钠溶液,进行下面的实验。
在试管中盛有上述AlCl3溶液10 mL,向其中逐滴滴入上述的NaOH溶液。
(1)加入10 mL NaOH溶液时的现象是________,加入30 mL NaOH溶液时的现象是________,加入35 mL NaOH溶液时的现象是____________________。
(2)生成沉淀质量最多时,需NaOH溶液________mL。
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
(1)HA的电离平衡常数K=_____________。
(2)升高温度时,K将_____________(填“增大”、“减小”或“不变”)。(3)由HA电离出的c(H+)约为水电离出的c(H+)的_____________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx都是大气污染物.
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是
(2)采取还原法,用炭粉可将氮氧化物还原.
已知:N2(g)+O2(g)═2NO(g)△H=+180.6kJmol﹣1;C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
则反应C(s)+2NO(g)═CO2(g)+N2(g)△H=kJmol﹣1 .
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为(填写“氧化剂”或“还原剂”).下式中X必须为无污染的物质,系数n可以为0;NO2+G ![]() N2+H2O+nX (未配平的反应式);
N2+H2O+nX (未配平的反应式);
下列化合物中,满足上述反应式中的G是(填写字母);
a.NH3b.CO2c.SO2d.CH3CH2OH
(4)利用氨水可以将SO2和NO2吸收,原理如图1所示:NO2被吸收的离子方程式是 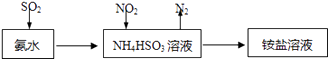
(5)利用图2所示装置(电极均为惰性电极)也可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 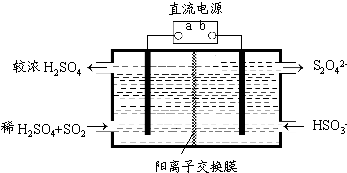
①b极的电极反应式为;
②在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO32﹣生成.该反应离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含1.00×10﹣2mol/L的Cr2O72﹣ , 其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 , 设计了如图实验,下列说明正确的是( ) 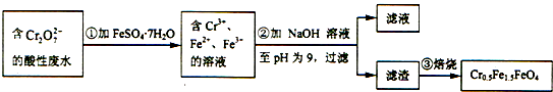
A.根据第①步反应可知还原性:Cr3+大于Fe2+
B.第②步过滤得到的滤渣中主要成分为Cr(OH)3、Fe(OH)2 , 不含Fe(OH)3
C.欲使1L该废水中的Cr2O72﹣完全转化为Cr0.5Fe1.5FeO4 , 理论上需要加入27.8g FeSO47H2O
D.第③步高温焙烧过程用到的主要实验仪器中属于硅酸盐质的有:酒精灯、蒸发皿、泥三角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下:
①2Na(s)+ ![]() O2(g)═Na2O(s)△H1=﹣414kJ/mol;
O2(g)═Na2O(s)△H1=﹣414kJ/mol;
②2Na(s)+O2(g)═Na2O2(s)△H2=﹣511kJ/mol.
下列说法正确的是( )
A.①和②生成等物质的量的产物,转移的电子数相同
B.Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
C.25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=+317 kJ/mol
D.①和②产物中的阴阳离子个数比均为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com