
【题目】由N、F、S、Cl、Cu、Ni等元素组成的物质在生产、生活中有着广泛的用途,回答下列问题.
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序但有严格准周期位置序的独特晶体.可通过________方法区分晶体、准晶体和非晶体,![]() 四氟乙烯分子中含
四氟乙烯分子中含![]() 键数目为________.
键数目为________.
(2)![]() 原子的价层电子轨道表达式
原子的价层电子轨道表达式![]() 价层电子排布图
价层电子排布图![]() 为________.
为________.
(3)![]() 、Cl、S电负性由大到小的顺序为________.
、Cl、S电负性由大到小的顺序为________.
(4)![]() 氟酸锑
氟酸锑![]() 是一种超强酸,离子
是一种超强酸,离子![]() 的空间构型为________,依次写出一种与
的空间构型为________,依次写出一种与![]() 具有相同空间构型和键合形式的分子和阴离子:________、________.
具有相同空间构型和键合形式的分子和阴离子:________、________.
(5)![]() 氟化铵
氟化铵![]() 可用作玻璃蚀刻剂、防腐剂、消毒剂等.
可用作玻璃蚀刻剂、防腐剂、消毒剂等.![]() 的中心原子的杂化类型是________;氟化铵中存在________
的中心原子的杂化类型是________;氟化铵中存在________![]() 填字母
填字母![]() .
.
A.离子键
B.![]() 键
键
C.![]() 键
键
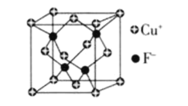
(6)![]() 的密度为
的密度为![]() ,CuF的晶胞结构如下图.CuF的晶胞参数
,CuF的晶胞结构如下图.CuF的晶胞参数![]() ________
________![]() 列出计算式
列出计算式![]() .
.
【答案】![]() 射线衍射
射线衍射 ![]()

![]()
![]() 型
型 ![]() 或
或![]()
![]()
![]()
![]()

【解析】
(1)X射线的衍射可以区分晶体、准晶体和非晶体;1个四氟乙烯分子中含5个![]() 键;
键;
(2)![]() 原子的价层电子排布式是3d84s2;
原子的价层电子排布式是3d84s2;
![]() 同周期自左而右电负性增大、同主族自上而下电负性减小;
同周期自左而右电负性增大、同主族自上而下电负性减小;
(4)离子![]() 中心原子F的价电子对数是
中心原子F的价电子对数是![]() ,孤电子对数是2;
,孤电子对数是2;
(5)![]() 的中心原子N的价电子对数是
的中心原子N的价电子对数是![]() ;
;
(6)根据![]() 晶胞的摩尔质量÷(晶胞的体积×
晶胞的摩尔质量÷(晶胞的体积×![]() )计算晶胞的边长。
)计算晶胞的边长。
![]() 从外观无法区分三者,但通过X射线的衍射实验,三者得到的谱线特征不同,X射线衍射实验可以区分三者;四氟乙烯,其结构简式为
从外观无法区分三者,但通过X射线的衍射实验,三者得到的谱线特征不同,X射线衍射实验可以区分三者;四氟乙烯,其结构简式为![]() ,1mol四氟乙烯分子中含
,1mol四氟乙烯分子中含![]() 键为5mol,则
键为5mol,则![]() 四氟乙烯分子中含
四氟乙烯分子中含![]() 键数目为
键数目为![]() ;
;
![]() 基态Ni原子价层电子的排布式为
基态Ni原子价层电子的排布式为![]() ,由泡利原理、洪特规则,可得轨道表达式为:
,由泡利原理、洪特规则,可得轨道表达式为:![]() ;
;
![]() 同周期自左而右电负性增大、同主族自上而下电负性减小,所以电负性:
同周期自左而右电负性增大、同主族自上而下电负性减小,所以电负性:![]() ;
;
![]() 中心原子F的价电子对数是
中心原子F的价电子对数是![]() ,孤电子对数是2,所以为V形;
,孤电子对数是2,所以为V形;
![]() 的N原子价电子对数是
的N原子价电子对数是![]() ,为
,为![]() 杂化,氟化铵为离子化合物,含有离子键和共价键,即
杂化,氟化铵为离子化合物,含有离子键和共价键,即![]() 键和离子键,没有双键,所以不含
键和离子键,没有双键,所以不含![]() 键;
键;
![]() 的密度为
的密度为![]() ,晶胞中F的个数为4,Cu为
,晶胞中F的个数为4,Cu为![]() ,则
,则 ,
, 。
。


科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种溶液:①醋酸溶液,②盐酸。下列说法错误的是
A.两溶液中水电离出的c(H+):①=②
B.两溶液分别加水稀释10倍,稀释后溶液的pH:②>①
C.取大小和形状完全相同的两块锌粒分别投入两种酸中,当产生相同体积的气体时所需的时间:①>②
D.等体积的两溶液分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学,均用惰性电极电解相同浓度的硫酸铜溶液,各通电一段时间后,甲、乙分别向所得的溶液中加入0.1 mol CuO和0.1 mol Cu(OH)2,都恰好使溶液恢复到电解前的浓度。则甲、乙在电解过程中转移的电子的物质的量之比为( )
A.1∶1B.1∶2C.1∶3D.1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
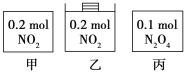
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如图所示。

(1)反应处于平衡状态的时间段是_________________。
(2)图中10~20 min内曲线发生变化的可能原因是_______________________________________。
(3)第25 min,平衡改变的条件是____________________________________,此时正反应速率_____(填“增大”“减小”或“不变”);重新达平衡后,NH3的体积分数比原平衡______(填“大”“小”或“不变”)。
(4)判断该反应达到平衡状态的标志是___________(填字母)。
a.N2和NH3的浓度相等
b.NH3的百分含量保持不变
c.容器中气体的压强不变
d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月3日瑞典皇家科学院宣布,将授予美国科学家弗朗西丝![]() 阿诺德、美国科学家乔治
阿诺德、美国科学家乔治![]() 史密斯和英国科学家格雷戈里
史密斯和英国科学家格雷戈里![]() 温特三位科学家2018年诺贝尔化学奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。获奖者已经利用达尔文原理开发出造福人类的新型化学品。第一个药物阿达木单抗于2002年获批,用于治疗类风湿关节炎、银屑病和炎症性肠病,其结构式如图1所示:
温特三位科学家2018年诺贝尔化学奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。获奖者已经利用达尔文原理开发出造福人类的新型化学品。第一个药物阿达木单抗于2002年获批,用于治疗类风湿关节炎、银屑病和炎症性肠病,其结构式如图1所示:

(1)阿达木单抗中碳原子的杂化方式为________,所含元素中前10号元素的电负性由小到大的顺序为________。
(2)弗朗西斯阿诺德主要研究酶的定向进化,金属酶含有一种或几种金属离子,金属酶种类很多,以含锌、铁、铜的酶最多,如铁金属酶一细胞色素,也有含有钼、锰等其他金属离子的酶。
![]() 基态Fe原子中,核外电子占据的轨道数为________,
基态Fe原子中,核外电子占据的轨道数为________,![]() 的价电子轨道表示式为________,检验
的价电子轨道表示式为________,检验![]() 常用KSCN溶液,其阴离子的等电子体为________
常用KSCN溶液,其阴离子的等电子体为________![]() 任写一种分子
任写一种分子![]() 。
。
![]() 与Fe属于同一周期,且核外最外层电子构型相同,但Ca的熔点沸点都比Fe低,原因是________。
与Fe属于同一周期,且核外最外层电子构型相同,但Ca的熔点沸点都比Fe低,原因是________。
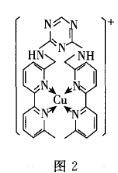
(3)![]() 是人体多种酶的辅助因子,其与某有机物生成的配位离子
是人体多种酶的辅助因子,其与某有机物生成的配位离子![]() 图
图![]() 具有酶的某些特性。该离子中存在的化学键有________。
具有酶的某些特性。该离子中存在的化学键有________。
![]() 离子键
离子键 ![]() 共价键
共价键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 范德华力
范德华力
(4)如图3是晶体![]() 的结构,该晶体是一种磁性材料,能导电。
的结构,该晶体是一种磁性材料,能导电。
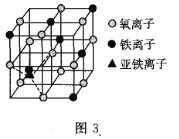
![]() 晶胞中铁离子处于氧离子围成的________
晶胞中铁离子处于氧离子围成的________![]() 填空间结构
填空间结构![]() 空隙。
空隙。
![]() 若晶胞的体对角线长为
若晶胞的体对角线长为![]() ,则
,则![]() 晶体的密度为________
晶体的密度为________![]()
![]() 阿伏加德罗常数用
阿伏加德罗常数用![]() 表示
表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液,所得溶液pH与加入的NaOH溶液体积的关系曲线如图所示,下列说法正确的是
的NaOH溶液,所得溶液pH与加入的NaOH溶液体积的关系曲线如图所示,下列说法正确的是 ![]()
![]()

A.a、b、c、d四个点中,水的电离程度最大的是d
B.a点溶液中:![]()
C.b点溶液中:![]()
D.c点溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列叙述的方法中,能将有机化合物 转变为
转变为 的有( )
的有( )
①跟足量NaOH溶液共热后,通入二氧化碳直至过量
②与稀硫酸共热后,加入足量Na2CO3溶液
③与稀硫酸共热后,加入足量NaOH溶液
④与稀硫酸共热后,加入足量NaHCO3溶液
⑤与足量的NaOH溶液共热后,再加入适量H2SO4
A.①②B.②③
C.③④D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com