
【题目】常温下,向![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液,所得溶液pH与加入的NaOH溶液体积的关系曲线如图所示,下列说法正确的是
的NaOH溶液,所得溶液pH与加入的NaOH溶液体积的关系曲线如图所示,下列说法正确的是 ![]()
![]()

A.a、b、c、d四个点中,水的电离程度最大的是d
B.a点溶液中:![]()
C.b点溶液中:![]()
D.c点溶液中:![]()
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学键及晶体的说法中,正确的是
A.Cl2、Br2、I2的沸点逐渐升高,是因为键能越来越大
B.N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构
C.金属钠的晶体采用简单立方堆积,每个晶胞含1个原子,配位数为6
D.石英晶体和干冰晶体熔沸点不同,是因为所含化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、F、S、Cl、Cu、Ni等元素组成的物质在生产、生活中有着广泛的用途,回答下列问题.
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序但有严格准周期位置序的独特晶体.可通过________方法区分晶体、准晶体和非晶体,![]() 四氟乙烯分子中含
四氟乙烯分子中含![]() 键数目为________.
键数目为________.
(2)![]() 原子的价层电子轨道表达式
原子的价层电子轨道表达式![]() 价层电子排布图
价层电子排布图![]() 为________.
为________.
(3)![]() 、Cl、S电负性由大到小的顺序为________.
、Cl、S电负性由大到小的顺序为________.
(4)![]() 氟酸锑
氟酸锑![]() 是一种超强酸,离子
是一种超强酸,离子![]() 的空间构型为________,依次写出一种与
的空间构型为________,依次写出一种与![]() 具有相同空间构型和键合形式的分子和阴离子:________、________.
具有相同空间构型和键合形式的分子和阴离子:________、________.
(5)![]() 氟化铵
氟化铵![]() 可用作玻璃蚀刻剂、防腐剂、消毒剂等.
可用作玻璃蚀刻剂、防腐剂、消毒剂等.![]() 的中心原子的杂化类型是________;氟化铵中存在________
的中心原子的杂化类型是________;氟化铵中存在________![]() 填字母
填字母![]() .
.
A.离子键
B.![]() 键
键
C.![]() 键
键
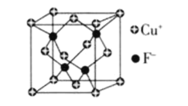
(6)![]() 的密度为
的密度为![]() ,CuF的晶胞结构如下图.CuF的晶胞参数
,CuF的晶胞结构如下图.CuF的晶胞参数![]() ________
________![]() 列出计算式
列出计算式![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阳离子交换膜电解槽运用到氯碱工业,使产品的纯度大大提高,主要归功于阳离子交换膜的严格把关,它只允许阳离子自由通过,其工作原理如图所示。

(1)在氯碱工业中电解饱和食盐水制备氢气、氯气和氢氧化钠溶液时,饱和食盐水的入口应该是______(填“C”或“D”)。
(2)该装置也可用于物质的提纯,工业品氢氧化钾的溶液中含有某些含氧酸根杂质(如SO42-),可以用阳离子交换膜电解槽电解提纯。除去杂质后氢氧化钾溶液从液体出口_________(填“A”或“B”)导出。
(3)阳离子交换膜的诞生极大促进了电解工业的发展,我们不妨大胆设想,假设阴离子交换膜也已经诞生,同时使用阳离子交换膜和阴离子交换膜电解硫酸钠溶液,可以同时制备产品氢气、氧气、氢氧化钠溶液和硫酸溶液四种物质。某同学设计了如图所示的装置,请你指出硫酸钠溶液的入口是_______(填“C”“G”或“D”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种锂离子二次电池的总反应为FePO4(s)+ Li(s) ![]() LiFePO4(s)装置如图所示(a极材料为金属锂和石墨的复合材料)。下列说法不正确的是( )
LiFePO4(s)装置如图所示(a极材料为金属锂和石墨的复合材料)。下列说法不正确的是( )

A.图中e―及Li+的移动方向说明该电池处于放电状态
B.该电池中a极不能接触水溶液
C.充电时a极连接外接电源的正极
D.充电时,b极电极反应式为:LiFePO4–e―= Li+ + FePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。

下列溶液中的关系中正确的是( )
A.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸![]() 、亚砷酸
、亚砷酸![]() 是两种弱酸。回答下列问题:
是两种弱酸。回答下列问题:
(1)常温下,向![]() 溶液中滴加
溶液中滴加![]() 溶液,混合溶液中由水电离的
溶液,混合溶液中由水电离的![]() 与KOH溶液的体积之间的关系如图所示。
与KOH溶液的体积之间的关系如图所示。

![]() 点对应溶液的pH________
点对应溶液的pH________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() __________。
__________。
![]() 在一定温度下,向某容器中加入一定量的
在一定温度下,向某容器中加入一定量的![]() 、
、![]() 和NaOH溶液,发生反应:
和NaOH溶液,发生反应:![]() ,
,![]() 的转化率
的转化率![]() 与时间的关系如图所示,测得F点对应溶液中
与时间的关系如图所示,测得F点对应溶液中![]() 、
、![]() ,且溶液
,且溶液![]() 。
。

![]() 点:
点:![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;E点的
;E点的![]() ______G点的
______G点的![]() 。
。
![]() 下列情况表明该反应达到平衡状态的是__________
下列情况表明该反应达到平衡状态的是__________![]() 填字母
填字母![]() 。
。
![]()
![]() 溶液颜色不再变化
溶液颜色不再变化
![]() 溶液的pH不再变化
溶液的pH不再变化 ![]() 溶液中
溶液中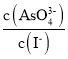 不再变化
不再变化
![]() 在该条件下,上述反应的平衡常数
在该条件下,上述反应的平衡常数![]() ____________
____________![]() 用含m的代数式表示
用含m的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下xA+yB![]() zC达到平衡时,请填写:
zC达到平衡时,请填写:
①若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是___。
②已知B、C是气体,现增加A的物质的量,平衡不移动,说明A是___(填状态)。
③若容器容积不变,加入气体B,气体A的转化率___(填“增大”“减小”或“不变”)。
④若加热后,C的百分含量减小,则正反应是___反应(填“放热”或“吸热”)。
⑤和原平衡相比,加催化剂达到平衡时,气体A的转化率___(填“增大”“减小”或“不变”)。
⑥若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,则___。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不移动 D.反应停止
(2)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____。

②下列说法正确的是___(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
③甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com