
【题目】甲、乙两同学,均用惰性电极电解相同浓度的硫酸铜溶液,各通电一段时间后,甲、乙分别向所得的溶液中加入0.1 mol CuO和0.1 mol Cu(OH)2,都恰好使溶液恢复到电解前的浓度。则甲、乙在电解过程中转移的电子的物质的量之比为( )
A.1∶1B.1∶2C.1∶3D.1∶4
【答案】B
【解析】
惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1 mol CuO恰好使溶液恢复到电解前的浓度,说明发生反应2H2O+2CuSO4 ![]() 2Cu+O2↑+2H2SO4;加入0.1molCu(OH)2后恰好恢复到电解前的浓度,说明该电解过程中相当于析出CuO和H2O,说明发生反应2H2O+2CuSO4
2Cu+O2↑+2H2SO4;加入0.1molCu(OH)2后恰好恢复到电解前的浓度,说明该电解过程中相当于析出CuO和H2O,说明发生反应2H2O+2CuSO4 ![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑,据此计算。
2H2↑+O2↑,据此计算。
加入0.1mol CuO后恢复到电解前的浓度,可知发生反应
2H2O+2CuSO4 ![]() 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
故转移电子的总物质的量为0.2mol;
Cu(OH)2从组成上可看成CuOH2O,加入0.1molCu(OH)2后恰好恢复到电解前的浓度,即电解了0.1mol硫酸铜溶液,并电解了0.1mol H2O,由电解的总反应式可知,
2H2O+2CuSO4![]() 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.1mol 0.2mol
2H2O![]() 2H2↑+O2↑ 转移电子
2H2↑+O2↑ 转移电子
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.2mol+0.2mol=0.4mol,则甲、乙在电解过程中转移的电子的物质的量之比为0.2mol:0.4mol=1:2,B项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如下图所示。下列说法不正确的是
随n(NaOH)的变化如下图所示。下列说法不正确的是

A. HX为强酸,HY为弱酸 B. b点时溶液呈中性
C. 水的电离程度:d>c D. c点时溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键及晶体的说法中,正确的是
A.Cl2、Br2、I2的沸点逐渐升高,是因为键能越来越大
B.N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构
C.金属钠的晶体采用简单立方堆积,每个晶胞含1个原子,配位数为6
D.石英晶体和干冰晶体熔沸点不同,是因为所含化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列五种溶液:
① | ② | ③ | ④ | ⑤ |
0.1 mol·L-1 CH3COOH溶液 | 0.01mol·L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 | 0.1 mol·L-1 NaOH溶液 | 0.1mol·L-1 氨水 |
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④
(2)在相同温度时100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是_______ (填字母)。
A .中和时所需NaOH的量 B .电离程度
C .水电离出的c(H+) D. CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A. B.
B.
C. c(H+)和c(OH-)的乘积 D.OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:_______________________________________。
(5)已知CH3COOH的电离平衡常数Ka=1.8×10-5 ,另一种二元弱酸H2B的电离平衡常数为K1=4.3×10- 4 ,K2=5.6×10-1 1 试写出向Na2B溶液中加入过量CH3COOH溶液的化学方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
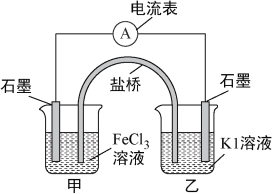
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、F、S、Cl、Cu、Ni等元素组成的物质在生产、生活中有着广泛的用途,回答下列问题.
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序但有严格准周期位置序的独特晶体.可通过________方法区分晶体、准晶体和非晶体,![]() 四氟乙烯分子中含
四氟乙烯分子中含![]() 键数目为________.
键数目为________.
(2)![]() 原子的价层电子轨道表达式
原子的价层电子轨道表达式![]() 价层电子排布图
价层电子排布图![]() 为________.
为________.
(3)![]() 、Cl、S电负性由大到小的顺序为________.
、Cl、S电负性由大到小的顺序为________.
(4)![]() 氟酸锑
氟酸锑![]() 是一种超强酸,离子
是一种超强酸,离子![]() 的空间构型为________,依次写出一种与
的空间构型为________,依次写出一种与![]() 具有相同空间构型和键合形式的分子和阴离子:________、________.
具有相同空间构型和键合形式的分子和阴离子:________、________.
(5)![]() 氟化铵
氟化铵![]() 可用作玻璃蚀刻剂、防腐剂、消毒剂等.
可用作玻璃蚀刻剂、防腐剂、消毒剂等.![]() 的中心原子的杂化类型是________;氟化铵中存在________
的中心原子的杂化类型是________;氟化铵中存在________![]() 填字母
填字母![]() .
.
A.离子键
B.![]() 键
键
C.![]() 键
键
(6)![]() 的密度为
的密度为![]() ,CuF的晶胞结构如下图.CuF的晶胞参数
,CuF的晶胞结构如下图.CuF的晶胞参数![]() ________
________![]() 列出计算式
列出计算式![]() .
.
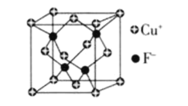
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阳离子交换膜电解槽运用到氯碱工业,使产品的纯度大大提高,主要归功于阳离子交换膜的严格把关,它只允许阳离子自由通过,其工作原理如图所示。

(1)在氯碱工业中电解饱和食盐水制备氢气、氯气和氢氧化钠溶液时,饱和食盐水的入口应该是______(填“C”或“D”)。
(2)该装置也可用于物质的提纯,工业品氢氧化钾的溶液中含有某些含氧酸根杂质(如SO42-),可以用阳离子交换膜电解槽电解提纯。除去杂质后氢氧化钾溶液从液体出口_________(填“A”或“B”)导出。
(3)阳离子交换膜的诞生极大促进了电解工业的发展,我们不妨大胆设想,假设阴离子交换膜也已经诞生,同时使用阳离子交换膜和阴离子交换膜电解硫酸钠溶液,可以同时制备产品氢气、氧气、氢氧化钠溶液和硫酸溶液四种物质。某同学设计了如图所示的装置,请你指出硫酸钠溶液的入口是_______(填“C”“G”或“D”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸![]() 、亚砷酸
、亚砷酸![]() 是两种弱酸。回答下列问题:
是两种弱酸。回答下列问题:
(1)常温下,向![]() 溶液中滴加
溶液中滴加![]() 溶液,混合溶液中由水电离的
溶液,混合溶液中由水电离的![]() 与KOH溶液的体积之间的关系如图所示。
与KOH溶液的体积之间的关系如图所示。

![]() 点对应溶液的pH________
点对应溶液的pH________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() __________。
__________。
![]() 在一定温度下,向某容器中加入一定量的
在一定温度下,向某容器中加入一定量的![]() 、
、![]() 和NaOH溶液,发生反应:
和NaOH溶液,发生反应:![]() ,
,![]() 的转化率
的转化率![]() 与时间的关系如图所示,测得F点对应溶液中
与时间的关系如图所示,测得F点对应溶液中![]() 、
、![]() ,且溶液
,且溶液![]() 。
。

![]() 点:
点:![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;E点的
;E点的![]() ______G点的
______G点的![]() 。
。
![]() 下列情况表明该反应达到平衡状态的是__________
下列情况表明该反应达到平衡状态的是__________![]() 填字母
填字母![]() 。
。
![]()
![]() 溶液颜色不再变化
溶液颜色不再变化
![]() 溶液的pH不再变化
溶液的pH不再变化 ![]() 溶液中
溶液中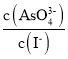 不再变化
不再变化
![]() 在该条件下,上述反应的平衡常数
在该条件下,上述反应的平衡常数![]() ____________
____________![]() 用含m的代数式表示
用含m的代数式表示![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com