


科目:高中化学 来源: 题型:
| A、甲酸能与水以任意比互溶 |
| B、1mol?L-1甲酸溶液的pH约为2 |
| C、10mL 1mol?L-1甲酸恰好与10mL 1mol?L-1NaOH溶液完全反应 |
| D、甲酸溶液的导电性比盐酸的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ①e处发生反应的离子方程式为
①e处发生反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
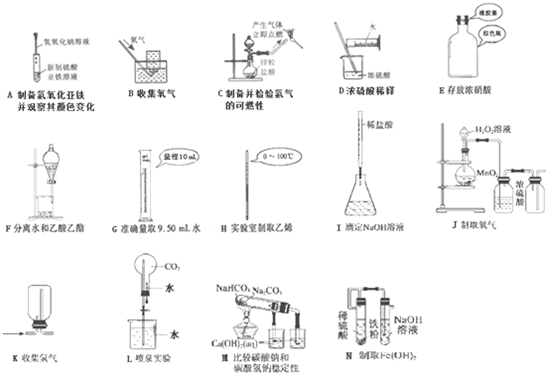
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ||||||||||||||||
| ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:查看答案和解析>>
科目:高中化学 来源: 题型:
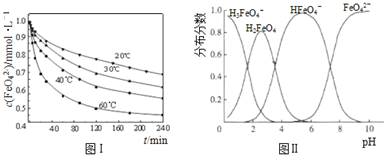
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com