
| n |
| V |
| 0.62×0.3 |
| 0.42 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| 编号 | 实验 | 离子方程式或电极反应式 | 评价 |
| A | 次氯酸钙溶液中通入少量SO2 | Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+ | 正确 |
| B | 硫酸铁溶液与足量的氢氧化钡溶液混合 | Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | 正确 |
| C | 醋酸铵溶于水 | CH3COO-+NH4++H2O?CH3COOH+NH3?H2O | 错误,阴离子水解相互促进,应该用“═”号 |
| D | 用铜作电极电解氯化铜和氯化钠的混合溶液一段时间 | 阴极:Cu2++2e-═Cu 阳极:4OH--4e-═2H2O+O2↑ |
错误,该阴阳两极得失电子不相等 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 5 |
A、N
| ||
B、中N
| ||
| C、化合物N5AsF6中不含离子键 | ||
| D、化合物N5AsF6中F的化合价一定为-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
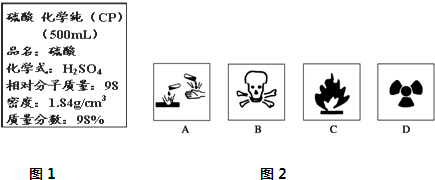
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64g Cu片(0.01mol)和20.0mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶液B,… |
| 操作 | 现象 | |
| 实验3 | 1、配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| 2、再加0.01mol Cu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| 3、加水稀释 | 溶液立即变为蓝色 | |
| 实验4 | 1、向20.0mL 0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| 2、加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com