
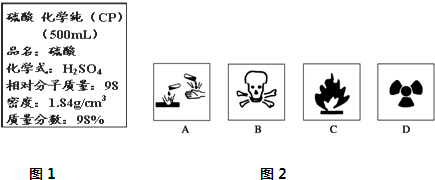
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
| 1000ρω |
| M |
| 1000x×98% |
| 98 |
| 1000y×49% |
| 98 |
| 2x |
| y |
| 18.4 |
| c |


科目:高中化学 来源: 题型:
| A、手机上用的锂离子电池属于二次电池 |
| B、废电池必须进行集中处理其首要原因是防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C、氢氧燃料电池可把电能转化为化学能,是一种具有应用前景的绿色能源 |
| D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
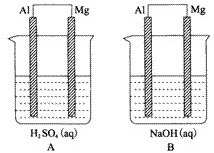
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ③白磷 ④氯水 ⑤
③白磷 ④氯水 ⑤ ⑥
⑥35 17 |
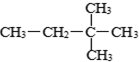 ⑧2,2-二甲基丁烷⑨红磷 ⑩
⑧2,2-二甲基丁烷⑨红磷 ⑩37 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:查看答案和解析>>
科目:高中化学 来源: 题型:
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com