
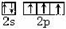 ,故答案为:
,故答案为: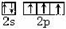 ;
;

科目:高中化学 来源: 题型:
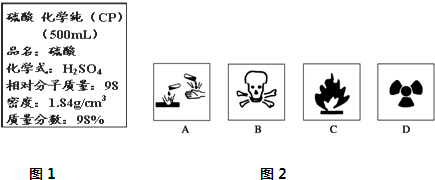
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | I | Ⅱ | Ⅲ |
| 实验 | 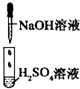 |
 |
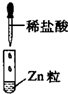 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A、I中混合前后溶液中各离子种类、个数均不变 |
| B、Ⅱ中反应前后溶液中Cu2+、Cl-浓度均未变 |
| C、Ⅱ中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同 |
| D、Ⅲ中发生的反应属于置换反应,不属于离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴苯中混有溴,加入KI溶液,用汽油萃取 |
| B、乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
| C、硝基苯中混有浓硝酸和浓硫酸,将其倒入浓烧碱溶液中,静置,然后分液 |
| D、乙烷中混有乙炔,通入高锰酸钾酸性溶液洗气除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com