
| A、1 L溶液中含3NA个K+ | ||
B、1 L溶液中含NA个S
| ||
| C、1 L溶液中K+浓度是6 mol?L-1 | ||
| D、1 L溶液中含6NA个离子 |


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| A、溶液与胶体的本质区别在于分散质微粒直径的大小,前者小于1nm,后者介于1nm-100nm之间 |
| B、纳米材料粒子直径一般从几纳米到几十纳米(1 nm=10-9m),因此纳米材料属于胶体 |
| C、鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化 |
| D、水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘粒子带电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH2Cl2有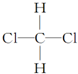 和 和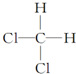 两种结构 两种结构 |
| B、烯烃跟氢气起加成反应产物是2,2,3,4-四甲基戊烷,则这样的烯烃有3种 |
C、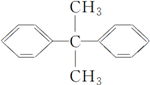 的一氯代物有5种 的一氯代物有5种 |
| D、1mol某烷烃完全燃烧消耗11mol O2,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 | B、3 | C、2 | D、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com