
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
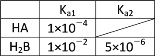
①25℃时,0.100 mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是: _______ 。pH=8的 NaA溶液中由水电离出的c(OH-)= _______ mol·L-1。
②25℃时,0.100 mol·L-1的NaHB溶液pH _______ 7,理由是 _______ 。
③25℃时,向0.100 mol·L-1的Na2B溶液中滴加足量0.100 mol·L-1的HA溶液,反应的离子方程式为_______ 。
(2)已知25℃时,向0.100 mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
①25℃,pH=3时溶液中c(H3PO4)∶c(H2PO![]() )=_______ 。
)=_______ 。
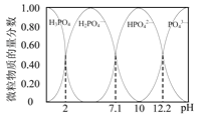
②当溶液pH由11到14时,所发生反应的离子方程式为:_______ 。
【答案】Na+、A-、OH-、HA、H+ 10-6 < HB-的电离程度大于其水解程度 HA+B2-=A-+HB- 1∶10(或0.1) HPO42-+OH-=PO43-+H2O
【解析】
(1)根据题给数据可知,HA、H2B是弱酸,由于Ka1(H2 B)>Ka1(HA)>Ka2(H2B),所以,酸性强弱关系为:H2 B>HA>HB-。
(2)分析图可知,向0.100 mol·L-1的H3PO4溶液中滴加NaOH溶液,H3PO4的含量逐渐下降,H2PO4-先增大后减小,HPO42-也是先增大后减小,PO43-一直增大;pH=2时,H3PO4和H2PO4-含量相等,pH=7.1时,H2PO4-和HPO42-含量相等, pH=12.2时,HPO42-和PO43-含量相等,这些信息可用于电离常数的计算。可在此基础上解各小题。
(1)①根据题意可知,HA是弱酸,所以A-会水解:A-+H2OHA+OH-,使溶液显碱性,但水解微弱;加上其它的水的电离,有c(OH-)>c(HA),所以各粒子物质的量浓度由大到小的顺序是:Na+、A-、OH-、HA、H+;NaA溶液中的c(OH-)均由水电离,所以,溶液中由水电离出的c(OH-)=10-14-10-8。答案为:Na+、A-、OH-、HA、H+;10-6;
②Ka1(H2B)×Ka2(H2B)=10-2×10-6=10-8>Kw,所以,HB-的电离程度大于其水解程度,NaHB溶液显酸性,pH<7。答案为:<;HB-的电离程度大于其水解程度;
③根据分析可知,酸性强弱关系为:H2B>HA>HB-。根据强酸制弱酸的规律,HA和Na2B溶液能反应生成HB-,但不能生成H2B,所以反应为:HA+B2-=A-+HB-。答案为:HA+B2-=A-+HB-;
(2)①根据分析可知,pH=2时,H3PO4和H2PO4-含量相等,则Ka1(H3PO4)= 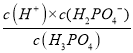 =c(H+)=10-2,则pH=3时有:10-2=
=c(H+)=10-2,则pH=3时有:10-2=![]() ,c(H3PO4)∶c(H2PO4-)=1∶10;
,c(H3PO4)∶c(H2PO4-)=1∶10;
②由图可知,当溶液pH由11到14时,所发生的变化主要是HPO42-→PO43-,所以该反应的离子方程式为:HPO42-+OH-=PO43-+H2O,答案为:HPO42-+OH-=PO43-+H2O。


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
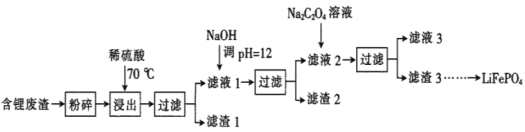
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
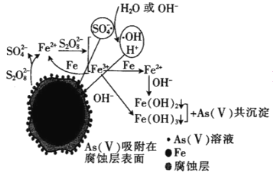
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
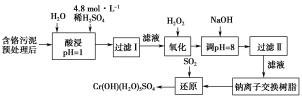
【题目】某工厂对工业污泥中的铬元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH如表所示:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7 | — | — | — |
沉淀完全时的pH | 3.2 | 9 | 11.1 | 8 | 9(>9溶解) |
(1)实验室用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是__________。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是__________。(用离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是________。
(5)钠离子交换树脂的原理为Mn++nNaR![]() MRn+nNa+,被交换的杂质离子是________。
MRn+nNa+,被交换的杂质离子是________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____Na2Cr2O7+____SO2+___ ___=___Cr(OH)(H2O)5SO4+___Na2SO4。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.将纯水加热后,水的电离程度增大,pH不变
B.反应2H2(g)+O2(g)=2H2O(l)在一定条件能自发进行的原因是ΔS<0
C.常温下,向0.1 mol·L-1 NH4Cl溶液中通入少量HCl,溶液中![]() 增大
增大
D.常温下,向CaCO3悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4![]() 6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
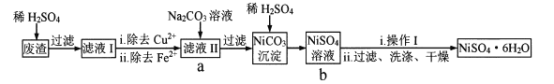
A. 溶解废渣时不能用稀盐酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”为蒸发浓缩、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用下图所示电解装置吸收和转化SO2(A、B均为惰性电极)。下列说法正确的是
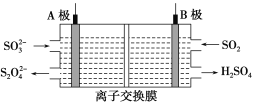
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e-+2H2O ===![]() +4H+
+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
B.向ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
C.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D.溶解度小的沉淀不能转化为溶解度大的沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com