

| A、由图甲可以判断:T1>T2,且反应的△H<0 |
| B、图乙表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、根据图丙,若除去CuSO4溶液中的Fe2+,可先向溶液中加入适量双氧水,再调节pH≈4 |
| D、图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |


科目:高中化学 来源: 题型:
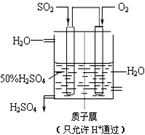 工业上生产硫酸时,将SO2氧化为SO3是关键一步.
工业上生产硫酸时,将SO2氧化为SO3是关键一步.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不断分离出液氨 |
| B、使用催化剂 |
| C、采用500℃的高温 |
| D、采用20-50Mp的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
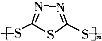 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )A、多硫化合物(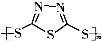 )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B、多硫化合物(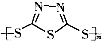 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C、原电池的负极反应是将单体 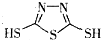 转化为 转化为 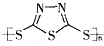 的过程 的过程 |
| D、当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中,氧化剂与还原剂物质的量之比为9:5 | ||
B、当反应中有1mol电子转移时,被还原氯气物质的量为
| ||
| C、每产生1mol O2时,被氧元素还原的氯气物质的量为2mol | ||
D、参加反应的水有
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa变成Na+时失去的电子数为NA |
| B、12g12C中所含12C的数目为NA |
| C、CaCl2溶液中若含有1.5NA个Ca2+,则含有3NA个Cl- |
| D、11.2LN2中含有的氮原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
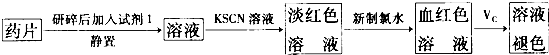
查看答案和解析>>
科目:高中化学 来源: 题型:
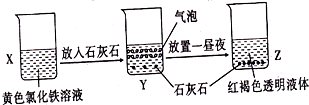
| A、利用过滤的方法,可将Z中固体与液体分离 |
| B、X、Z烧杯中分散质相同 |
| C、Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3 CO2↑+3 Ca2+ |
| D、Z中分散系能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com