
| A、1molNa变成Na+时失去的电子数为NA |
| B、12g12C中所含12C的数目为NA |
| C、CaCl2溶液中若含有1.5NA个Ca2+,则含有3NA个Cl- |
| D、11.2LN2中含有的氮原子数目为NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Na2CO3→NaHCO3 |
| B、SiO2→H2SiO3 |
| C、Fe(OH)2→Fe(OH)3 |
| D、NH4Cl→NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、53g碳酸钠中含NA个CO32- |
| B、标准状况下11.2L臭氧中含NA个氧原子 |
| C、1.8g水中含NA个中子 |
| D、0.1molOH-含NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、由图甲可以判断:T1>T2,且反应的△H<0 |
| B、图乙表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、根据图丙,若除去CuSO4溶液中的Fe2+,可先向溶液中加入适量双氧水,再调节pH≈4 |
| D、图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.9 g 2CaSO4?H2O中含有的结晶水分子数为0.02NA |
| B、30 g乙酸和葡萄糖的混和物中含碳原子数为NA |
| C、在铁与硫的反应中,1 mol铁失去的电子数为3NA |
| D、62 g Na2O溶于水后所得溶液中含有的O2-数为NA足量溶液A充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
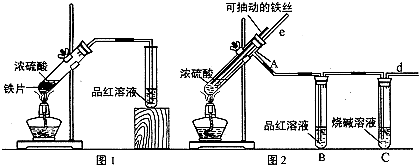
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B单质可能是金属,也可能是非金属 |
| B、B与A形成的化合物一定是离子化合物 |
| C、C单质只有氧化性 |
| D、原子半径:C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com