

| c(H2)c(I2) |
| c2(HI) |
| c(H2)c(I2) |
| c2(HI) |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
| A、第一电离能:As<Se,电负性As<Se |
| B、在AsCl3分子中,砷和氯原子核外电子数均为8 |
| C、砷酸的酸性比亚砷酸强,且砷酸钠溶液呈碱性 |
| D、AsH3的VSEPR模型为三角锥形,其中As原子采取sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
 反应的化学方程式为
反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
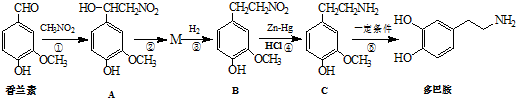
 )是生物体中重要的生物碱.写出用甲苯、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是生物体中重要的生物碱.写出用甲苯、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选).合成路线流程图示例如下:| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室合成乙酸乙酯粗产品的步骤如下:
实验室合成乙酸乙酯粗产品的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素A、C、D的单质均能与E的单质反应,且反应均为放热反应 |
| B、元素D的最高价氧化物与B、C、E的最高价氧化物对应的水化物之间均能发生反应 |
| C、化合物AE与CE含有相同类型的化学键 |
| D、元素B、D分别与E形成的化合物中每个原子最外层均满足8电子的稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com