
【题目】已知溶液中的化学反应大多是离子反应。根据要求回答下列问题。
(1)水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________(填 “左”或“右”)移动, 且所得溶液显____ 性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________(填 “左”或“右”)移动, 且所得溶液显____ 性。
(2)向水中加NaHCO3固体,水的电离平衡向____(填“左”或“右”)移动,且所得溶液显____ 性。
(3)常温下,0.1 mol·L-1 CH3COONa溶液的pH为9,则由水电离出的c(H+)=________。
(4)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m____n ( 填“>”“<”或“=”)。
【答案】左 酸 右 碱 1×10-5 mol/L <
【解析】
(1)硫酸氢钠完全电离生成氢离子,导致溶液呈强酸性,抑制水电离;
(2)向水中加NaHCO3固体,是强碱弱酸盐,水解对水的电离起促进作用,溶液呈碱性;
(3)能水解的盐溶液促进了水的电离,碱溶液中的氢离子是水电离的,CH3COONa溶液中的氢氧根离子是水电离的;
(4)稀释会促进弱电解质的电离。
(1)硫酸氢钠完全电离生成氢离子,导致溶液呈强酸性,抑制水电离,水的电离平衡逆向移动,因此,本题正确答案是:左;酸;
(2)向水中加NaHCO3固体,是强碱弱酸盐,水解对水的电离起促进作用,所以水的电离平衡向右移动,谁强显谁性,溶液呈碱性,
因此,本题正确答案是:右;碱;
(3)能水解的盐溶液促进了水的电离,碱溶液中的氢离子是水电离的,CH3COONa溶液中的氢氧根离子是水电离的,所以c(OH-)=![]() =1×10-5mol/L,水电离出氢离子与氢氧根离子的浓度相等,
=1×10-5mol/L,水电离出氢离子与氢氧根离子的浓度相等,
因此,本题正确答案是:1×10-5 mol/L;
(4)稀释会促进弱电解质的电离,故若取pH、体积均相等的NaOH和氨水分别加水稀释m倍、n稀释后pH仍相等,则氨水稀释倍数大,
因此,本题正确答案是:<。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:

下列说法不正确的是
A. 合成气的主要成分为CO和H2
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. ①→②吸收能量
D. Ni在该反应中做催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,可逆反应C(s)+CO2(g)![]() 2CO(g),达到平衡状态的标志是( )
2CO(g),达到平衡状态的标志是( )
①单位时间内生成n molCO2的同时生成n molC ②单位时间内生成n molCO2 的同时生成2n mol CO ③CO2 、CO的物质的量浓度之比为1: 2的状态 ④混合气体的密度不再改变的状态 ⑤混合气体的压强不再改变的状态 ⑥C的质量不再改变的状态
A. ①④⑤⑥ B. ②④⑤⑥ C. ②③⑤⑥ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Cu和CuO的混合物中加入0.6 L2.0 mol/L的稀硝酸,混合物完全溶解,同时生成标准状况下NO 4.48 L。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,将沉淀洗涤,充分灼烧后得32.0 g固体。求:
(1)混合物中Cu的质量是____________。
(2)混合物消耗HNO3的物质的量是____________。
(3)NaOH溶液的体积是____________。
(4)Cu2+完全反应后,溶液中NO3-的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定分析法又叫容量分析法,是一种重要的定量分析法。酸碱中和滴定是重要的滴定分析实验。
(1)现用已知浓度的NaOH溶液,用中和滴定法去测定未知浓度的CH3COOH溶液,实验步骤如下,请填写有关内容:
① 将酸式滴定管洗净后,每次用3~4 mL待测醋酸溶液润洗2~3次,然后加入待测醋酸至0刻度以上。把滴定管夹在滴定管夹上,转动活塞,放出少量溶液,使滴定管________,并使液面达到________,记录初始读数。
② 用相似的方法在碱式滴定管中加入标准NaOH溶液,并调节好液面。
③ 在酸式滴定管内取V mL的待测醋酸移到洗净的锥形瓶中,加2~3滴________作指示剂。
④ 用标准NaOH溶液滴定待测醋酸。左手________,向锥形瓶中慢慢滴加NaOH溶液,右手轻轻摇动锥形瓶,两眼注视________,当溶液颜色由无色变为粉红色,且半分钟内不褪色,表示达到滴定终点,记录终点读数。
⑤ 重复上述实验步骤。
(2) 指示剂的选择一般根据滴定突跃,其选择标准是________。
(3) 已知标准NaOH溶液的浓度为0.1000 mol·L-1,所取待测醋酸的体积V均为20.00 mL。实验过程记录的数据如下表,求待测醋酸的物质的量浓度________。
滴定前 | 第一次 终点 | 第二次 终点 | 第三次 终点 | |
碱式滴定管 液面刻度 | 0.10 mL | 19.12 mL | 18.15 mL | 19.08 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
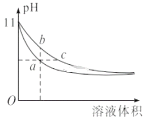
A. a点导电能力比b点强
B. a、c两点的c(H+)相等
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. b点的Kw值大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 由MgCl2溶液制备无水MgCl2,将MgCl2溶液加热蒸干
B. 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合下图回答问题。
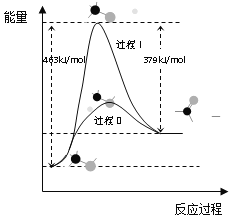
①此反应的热化学方程式是______
②反应活化能:过程I___过程II(填“>”“=”或“<”)
③过程II温度—转化率图如下,下列说法合理的是_____
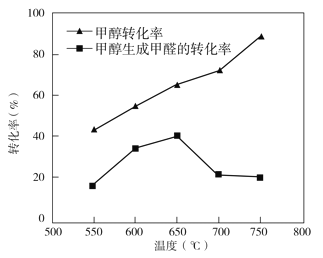
a.甲醇脱氢法制备甲醛过程无副反应发生
b.温度高于 650℃催化剂烧结,活性减弱
c.及时分离产品有利于提高甲醇生成甲醛的转化率
(2)甲醛超标会危害人体健康,需对甲醛进行含量检测及污染处理。
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为____,当电路中转移4×10-4 mol电子时,传感器内参加反应的甲醛(HCHO)为_____mg。

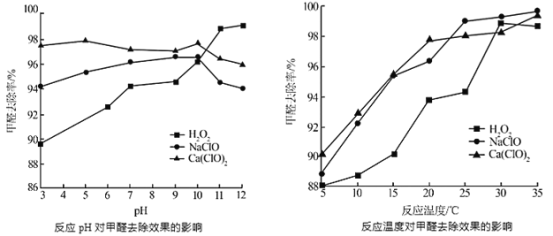
②氧化剂可处理甲醛污染,结合以下图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降冰片二烯类化合物是一类太阳能储能材料。降冰片二烯在紫外线照射下可以发生下列转化。下列说法错误的是( )
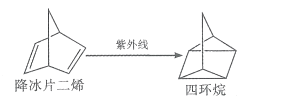
A. 降冰片二烯与四环烷互为同分异构体
B. 降冰片二烯能使酸性高锰酸钾溶液褪色
C. 四环烷的一氯代物超过三种(不考虑立体异构)
D. 降冰片二烯分子中位于同一平面的碳原子不超过4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com