
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合下图回答问题。
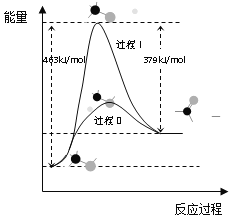
①此反应的热化学方程式是______
②反应活化能:过程I___过程II(填“>”“=”或“<”)
③过程II温度—转化率图如下,下列说法合理的是_____
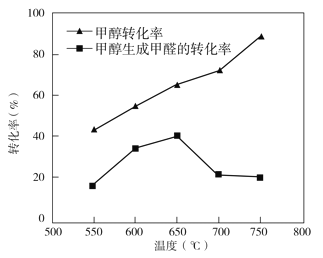
a.甲醇脱氢法制备甲醛过程无副反应发生
b.温度高于 650℃催化剂烧结,活性减弱
c.及时分离产品有利于提高甲醇生成甲醛的转化率
(2)甲醛超标会危害人体健康,需对甲醛进行含量检测及污染处理。
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为____,当电路中转移4×10-4 mol电子时,传感器内参加反应的甲醛(HCHO)为_____mg。

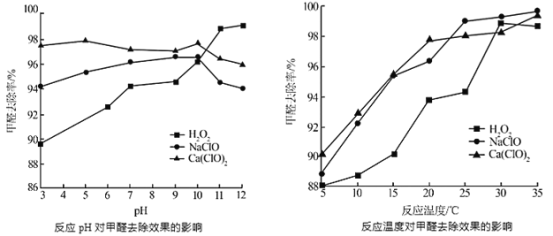
②氧化剂可处理甲醛污染,结合以下图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为______
【答案】CH3OH(g)=HCHO(g)+H2(g)⊿H=+84kJ/mol > b、c HCHO-4e-+ H2O= CO2+ 4H+ 3 Ca(ClO)2
【解析】
(1)①由图可知1molCH3OH脱氢生成1molHCHO和1molH2要吸收能量463kJ/mol-379kJ/mol=84kJ/mol,据此写出热化学方程式;
②由图可知反应活化能:过程I>过程II;
③a.由图可知,甲醇转化率大于甲醇生成甲醛的转化率,说明有其它副反应发生;
b.由图可知,温度高于 650℃甲醇生成甲醛的转化率降低,说明催化剂烧结,活性减弱;
c.减小生成物浓度平衡向正反应方向移动,所以及时分离产品有利于提高甲醇生成甲醛的转化率;
(2)①由图可知,甲醛气体传感器为原电池原理,b极为负极,甲醛发生氧化反应生成CO2,以此书写电极反应式;根据电极反应式计算反应的甲醛的量。
②分析图像可知,水温约15℃时选择Ca(ClO)2处理甲醛污染的水源,甲醛去除率较高。
(1)①由图可知1molCH3OH脱氢生成1molHCHO和1molH2要吸收能量463kJ/mol-379kJ/mol=84kJ/mol,所以反应的热化学方程式是CH3OH(g)=HCHO(g)+H2(g)⊿H=+84kJ/mol,
故答案为:CH3OH(g)=HCHO(g)+H2(g)⊿H=+84kJ/mol;
②由图可知反应活化能:过程I>过程II,
故答案为:>;
③a.由图可知,甲醇转化率大于甲醇生成甲醛的转化率,说明有其它反应发生,所以甲醇脱氢法制备甲醛过程有副反应发生,故a错误;
b.由图可知,温度高于 650℃甲醇生成甲醛的转化率降低,说明催化剂烧结,活性减弱,故b正确;
c.减小生成物浓度平衡向正反应方向移动,所以及时分离产品有利于提高甲醇生成甲醛的转化率,故c正确。
故答案为:b、c;
(2)①由图可知,甲醛气体传感器为原电池原理,b极为负极,甲醛发生氧化反应生成CO2,电极反应式为HCHO-4e-+ H2O= CO2+ 4H+;由反应式可知,当电路中转移4×10-4 mol电子时,传感器内参加反应的甲醛(HCHO)为![]() 30g/mol=3
30g/mol=3![]() 10-3g=3mg。
10-3g=3mg。
②分析图像可知,水温约15℃时选择Ca(ClO)2处理甲醛污染的水源,甲醛去除率较高,且甲醛去除率受pH的影响不大;
故答案为:3;Ca(ClO)2。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将_________,平衡将如何移动 ;
(2)加入正催化剂,反应速率将_________,平衡将如何移动 ;
(3)充入更多的H2,反应速率将_________,平衡将如何移动 ;
(4)扩大容器的体积,反应速率将_________,平衡将如何移动 ;
(5)容器体积不变,通入氖气,反应速率将___________,平衡将如何移动 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中的化学反应大多是离子反应。根据要求回答下列问题。
(1)水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________(填 “左”或“右”)移动, 且所得溶液显____ 性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________(填 “左”或“右”)移动, 且所得溶液显____ 性。
(2)向水中加NaHCO3固体,水的电离平衡向____(填“左”或“右”)移动,且所得溶液显____ 性。
(3)常温下,0.1 mol·L-1 CH3COONa溶液的pH为9,则由水电离出的c(H+)=________。
(4)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m____n ( 填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是
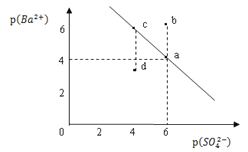
A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
金属离子 | Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?________________________________,该反应的离子方程式为_________________________________。
(2)溶液II中除Cu2+外,还有______金属离子,检验试剂为______________。物质Y不能为下列的________________________。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
(3)常温下,除去CuCl2溶液中的Fe2+,加入氧化剂X,使Fe2+氧化为Fe3+,然后加入物质Y至溶液pH=4,此时c(Fe3+)=_________mol/L,[已知Fe(OH)3的Ksp=4×10-38]
(4)若在空气中加热固体CuCl2·2H2O,可水解生成Cu(OH)Cl,写出相关的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法正确的是
A. 石墨转变为金刚石的反应是吸热反应
B. 白磷比红磷稳定
C. S(g)=S(s) ΔH>0
D. H2(g)+I2(g)![]() 2HI(g) ΔH>0
2HI(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是甲、乙、丙三位同学制取乙酸乙酯的实验过程,请完成相关问题。
(实验目的)制取乙酸乙酯
(实验原理)甲、乙、丙三位同学均采用乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯
(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:

请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃导管改成了球形干燥管,除起冷凝作用外,另一重要作用是________________。
(实验步骤)
(1)按所选择的装置组装仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2mL冰醋酸,加入2~3块碎瓷片;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
(问题讨论)
a.步骤(1)组装实验装置,加入药品前还应检查________;
b.写出试管①中发生反应的化学方程式(注明反应条件):________________;
c.试管②中饱和Na2CO3溶液的作用是________________;
d.从试管②中分离出乙酸乙酯的实验操作是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com