
| 操作 | 可能的实验现象 | 解释 | |||
| A | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO
| ||
| B | 向CaSO3中加入硝酸 | 有刺激性气味的气体生成 | CaSO3与硝酸反应生成SO2 | ||
| C | 同温同压下用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠溶液发生了水解 | ||
| D | 向淀粉KI溶液中通入Cl2 | 溶液变蓝 | Cl2与淀粉发生显色反应 |
| A、A | B、B | C、C | D、D |


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象与结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据溶液中的金属离子和残留固体的成分最多会有5种情况 |
| B、若金属有剩余,在溶液中再滴入稀硫酸后,金属不会溶解 |
| C、当合金刚好溶解时,在标准状况下产生2.24LNO |
| D、若合金全部溶解,在溶液中加入过量的氨水,(已知铜离子可转化为四氨合铜络离子溶于水)则经过滤、洗涤、干燥、充分灼烧、称量可得固体4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极为纯净气体,阴、阳两极产生的气体体积比≤1:1 |
| B、阳极为纯净气体,阴、阳两极产生的气体体积比≥1:1 |
| C、阳极为混合气体,阴、阳两极产生的气体体积比≤1:1 |
| D、阳极为混合气体,阴、阳两极产生的气体体积比≥1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
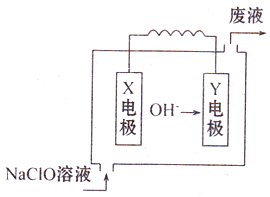 如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.
如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用肉眼观察区别溶液、胶体和浊液 |
| B、用BaCl2溶液鉴别Na2SO3是否变质 |
| C、用澄清石灰水鉴别Na2CO2溶液和NaHCO3溶液 |
| D、用NaOH除去Mg中混有的少量Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前 读数 | 滴定后 读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V(平)= |
| 2 | 20.00 | 6.00 | 26.00 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molN2与0.3molH2在密闭容器催化剂作用下充分反应,生成氨分子数为0.2NA |
| B、标准状况下,11.2L甲醛气体中电子数为8NA |
| C、常温常压下,7.8g苯中含有单键的数目为0.9NA |
| D、1L浓度为1mol?L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com