
【题目】下列说法正确的是
A.12C可用于考古断代,推算出文物的年代
B.在一定温度和压强下,气体体积主要取决于气体分子之间的平均间距
C.道尔顿、阿伏伽德罗、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识
D.确定物质中含有哪些金属元素可用原子吸收光谱
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是
A.H+、 Na+、HCO3-、Cl- B.Cu2+、Na+、 Cl-、、SO42-
C.Mg2+、K+、SO42-、OH- D.Ag+、Al3+、NO3- 、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,生成物不随反应条件或反应物用量的变化而变化的是( )
A. Na和O2 B. Fe和稀HNO3 C. Cu和FeCl3溶液 D. Na2CO3和稀HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
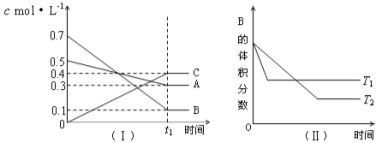
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A 、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 0.2 molX元素的离子被还原成中性原子时,需要得到2.408×1023个电子,0.3gX的单质与足量盐酸反应放出0.015g氢气;X的中子数和质子数相等;Y的原子半径是其所在周期元素中最小的,它的阴离子结构与氩原子结构相同。
(1)计算X的相对原子质量(写出计算过程)
(2)用化学方程式表示X最高价氧化物对应的水化物与Y单质的反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
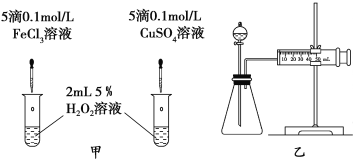
①定性分析:如图甲可通过观察__________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是 ,实验中需要测量的数据是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________________。
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律
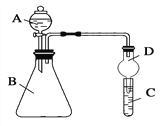
(3)上面装置中D装置的作用是为防止_____________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com