
【题目】请补充完成下列方程式![]() 配平或按要求写方程式
配平或按要求写方程式![]()
(1)______NH3+_________O2=___________NO+____________H2O
(2)_____________NO2+____________NaOH=____________NaNO2+____________NaNO3+________H2O
(3)____________Fe(OH)3+____________OH-+____________Cl2=____________FeO42-+____________Cl-+____________H2O
(4)___________Cu(IO3)2+____________KI+____________H2SO4=____________CuI↓+____________I2+____________K2SO4+___________H2O
(5)_______MnO4-+_______C2O42-+_______=_______Mn2++_______CO2↑+______________
(6)NaAlH4是一种重要的还原剂,它与水发生氧化还原反应的化学方程式是________。
【答案】![]() 5 4 6
5 4 6 ![]() 2 1 1 1
2 1 1 1 ![]() 10 3 2 6 8
10 3 2 6 8 ![]() 24 2 12 2 13 12 2 5 16 2 10 8 NaAlH4+2H2O=NaAlO2+4H2↑
24 2 12 2 13 12 2 5 16 2 10 8 NaAlH4+2H2O=NaAlO2+4H2↑
【解析】
对于氧化还原反应,先根据元素化合价升降总数相等,配平参加氧化还原反应的元素,再根据原子守恒,配平没有参加氧化还原反应的元素,对于离子反应,还应该遵循电荷守恒。
(1)在该反应中NH3中氮元素化合价升高5,氧元素化合价降低2,氧气作为整体参加反应,最少一个O2分子参加,则化合价降低2×2,化合价升降总数相等,最小公倍数是20,NH3、NO系数是4,O2的系数是5,则H2O的系数是6,配平后的方程式为4NH3+5O2=4NO+6H2O;
(2)在该反应中只有N元素化合价发生变化,由NO2变为NaNO2,化合价降低1价;由NO2变为NaNO3,化合价降低1价,根据质量守恒定律及化合价升降法配平可得2NO2+2NaOH=NaNO2+NaNO3+H2O;
(3)反应中Cl2→Cl-,Cl元素的化合价由0价降低为-1价,共降低2价,Fe(OH)3→FeO42-,Fe元素的化合价由+3价升高为+6价,升高了3价,化合价升降最小公倍数为6,故Fe(OH)3、FeO42-的系数为2,Cl2的系数为3,Cl-的系数是6,再由电荷及原子守恒可知反应方程式为:2Fe(OH)3+10OH-+3Cl2=2FeO42-+6Cl-+8H2O;
(4)反应中Cu元素的化合价由反应前Cu(IO3)2中Cu的+2价降低为CuI中的+1价,I元素的化合价由反应前Cu(IO3)2中的+5价降低为I2中的0价,化合价共降低11价,KI中I元素的化合价由-1价升高为I2中的0价,共升高1价,化合价升降的最小公倍数为11,初步确定Cu(IO3)2的系数为1,KI的系数11,再根据质量守恒定律及化合价升降法配平可得Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O;
(5)根据氧化还原反应化合价升降总数相等配平,在反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,降低5价,C2O42-→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价升降的最小公倍数为10,故MnO4-、Mn2+系数为2,C2O42-系数为5,CO2的系数是10,再根据电荷守恒确定H+的系数是16,最后根据元素原子守恒可知H2O的系数是8,配平后的离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
(6)NaAlH4是一种重要的还原剂,与水反应生成氢气,即NaAlH4中H化合价升高,水中H元素化合价降低,根据元素化合价升降总数相等及原子守恒,可得化学反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑。


科目:高中化学 来源: 题型:
【题目】由短周期元素组成的常见的纯净物,它们之间转化关系如图所示(可以在水溶液中反应)
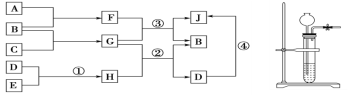
a.A、B、H在常温下均呈气态,F为液态,E为盐酸,D为溶于水的白色固体,A、B、C为单质,A在B中燃烧产生淡蓝色火焰。
b.实验室制取A、H的发生装置如图所示。
c.隔绝空气条件下,将G投入绿矾溶液中,有红褐色沉淀生成,还产生大量气泡。回答下列问题:
(1)化合物G中阳离子与阴离子个数之比为____________;J中所含化学键类型是____________________________________________。
(2)写出下列反应的化学方程式:
②_____________________________________________________;
③_____________________________________________________。
(3)反应①的离子方程式是____________________________________________
(4)化合物G有重要用途,用途为______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在25 ℃条件下将pH=12的氨水稀释过程中,下列关系式正确的是________。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中![]() 比值增大
比值增大
D.此过程中Kw增大
②在25 ℃条件下将pH=12的氨水稀释100倍后溶液的pH为________(填序号)。
A.10 B.11 C.10~12 D.11~13
(2)25 ℃时,向0.1 mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是________(填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2 mol NH4Cl和0.1 mol NaOH全部溶于水,形成混合溶液(假设无损失)。
①________和________两种粒子的物质的量之和等于0.2 mol。
②________和________两种粒子的物质的量之和比OH-多0.1 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(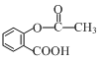 )是应用广泛的解热镇痛药,通过乙二醇将阿司匹林连接在高聚物E上,可制得缓释长效阿司匹林,其合成路线如图(部分反应条件已略去):
)是应用广泛的解热镇痛药,通过乙二醇将阿司匹林连接在高聚物E上,可制得缓释长效阿司匹林,其合成路线如图(部分反应条件已略去):
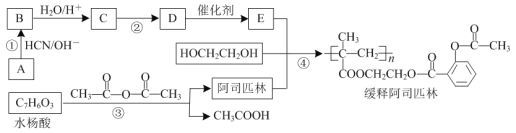
已知:CH3CHO![]()
回答下列问题:
(1)反应①的反应类型是___。
(2)反应②的化学方程式为___。
(3)写出同时满足下列条件的阿司匹林的一种同分异构体的结构简式:___。
Ⅰ.属于芳香族化合物,能与NaHCO3溶液反应;
Ⅱ.能发生水解反应,酸性条件下水解所得有机物中均含有两种不同化学环境的氢。
(4)写出以![]() 为原料制备药物中间体Y(
为原料制备药物中间体Y(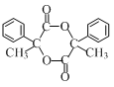 )的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
)的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子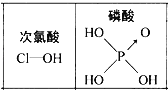
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F可通过如下路线合成得到:
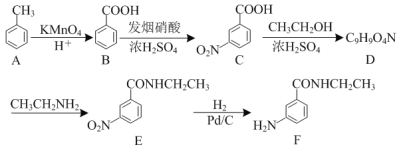
(1)F中的含氧官能团的名称为___。D→E的反应类型为___。
(2)写出D的结构简式:___。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
①含苯环,既能发生银镜反应、也能发生水解反应;
②是一种α-氨基酸,分子中含6种不同化学环境的氢。
(4)已知:苯胺(![]() )有弱碱性、易被氧化。写出以
)有弱碱性、易被氧化。写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备 的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是![]()
A.![]() 溶液与烧碱溶液反应,当
溶液与烧碱溶液反应,当![]() 时,
时,![]()
B.当向饱和![]() 溶液中通入过量
溶液中通入过量![]() 时,
时,![]()
C.![]() 溶液与NaHS溶液反应,当
溶液与NaHS溶液反应,当![]() 时,
时,![]()
D.Fe与稀硝酸反应,当 ![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1molN2时,转移的电子数为___mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
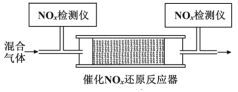
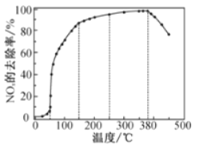
反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com