
【题目】某固体可能含有 Ba2+、NH4 + 、Cu2+、Na +、Cl -、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验:
(1)一份固体溶于水得到无色透明溶液。加入足量的 BaCl2 溶液,得到沉淀 6.63g;在沉淀中加入过量 的稀盐酸,仍有 4.66g 沉淀。
(2)另一份固体与过量的 NaOH 固体混合后充分加热,产生气体 1.344L(标准状况)。已知NH4 + OH-=NH3↑H2O ,则下列说法正确的是( )
A. 该固体中一定只含有 NH4 + 、CO32-、SO42-
B. 该固体中一定没有Cu2+、Na +、Ba2+、Cl-
C. 该固体中一定含有NH4 + 、Na +、Cl -、CO32-、SO42-
D. 若该固体中含有 Na+,则一定含有 Cl-,且二者等量
【答案】D
【解析】
根据离子共存条件分析解答。
(1)一份固体溶于水得无色透明溶液,说明不含Cu2+,加入足量BaCl2溶液,得沉淀6.63,在沉淀中加入过量稀盐酸,沉淀变成4.66g,说明沉淀一部分溶于盐酸,一部分不溶于稀盐酸,所以溶液中一定含有SO42-和 CO32-, n(SO42-)=n(BaSO4)=![]() =0.02mol,n(CO32-)=n(BaCO3)=
=0.02mol,n(CO32-)=n(BaCO3)=![]() =0.01mol;
=0.01mol;
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气1.344L即0.06mol(标准状况),所以含有铵根离子0.06mol;根据溶液中电荷守恒,其中CO32-和SO42-提供的负电荷的物质的量为:2×n(SO42-)+ 2×n(CO32-)=0.06mol,NH4+提供的正电荷的物质的量为:1×n(NH4+)=0.06mol,若固体形成的溶液中含有Na+,就一定含有Cl-,以维持溶液中的电荷平衡,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】氯的含氧酸根离子有ClO-、ClO、ClO、ClO等,关于,它们的说法中不正确的是( )
A. ClO-中Cl显+1价 B. ClO的空间构型为直线形
C. ClO的空间构型为三角锥形 D. ClO是SO![]() 的等电子体
的等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入100g原粮,E中加入20.00mL 1.50×l0-3mol/L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)仪器D的名称是________________________。
(2)AlP与水反应的化学方程式为__________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸( )的碱性溶液,其作用是_____________________________。
)的碱性溶液,其作用是_____________________________。
(4)通入空气的作用是____________________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为______________。(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-4mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为______________, 则该原粮中磷化物(以PH3计)的含量为_____ mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氧代环戊羧酸乙酯(K)是常见医药中间体,聚酯G是常见高分子材料,它们的合成路线如下图所示:
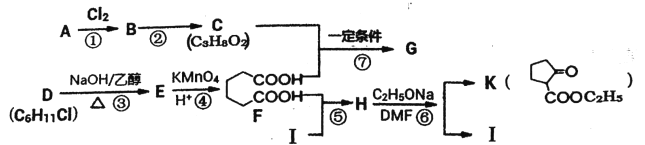
已知:①气态链烃A在标准状况下的密度为1.875g·L-1;
(1)B的名称为__________;E的结构简式为__________。
(2)下列有关K的说法正确的是__________。
A.易溶于水,难溶于CCl4
B.分子中五元环上碳原子均处于同一平面
C.能发生水解反应加成反应
D.1molK完全燃烧消耗9.5molO2
(3)⑥的反应类型为__________;⑦的化学方程式为__________
(4)与F官能团的种类和数目完全相同的同分异构体有__________种(不含立体结构),其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是__________(写结构简式)。
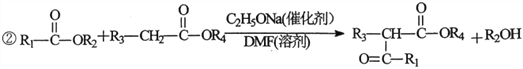
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料(其他无机试剂任选)制备![]()
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClcxH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 45,用浓度为 0.08000molL1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTACu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl23H2O B. Cu2(OH)3ClH2O
C. Cu(OH)Cl2H2O D. Cu2(OH)Cl33H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 100mL BaCl2、AlCl3 和 FeCl3 的混合溶液 A 中逐滴加入 Na2SO4 和 NaOH 的混合溶液 B,产生的沉淀 的物质的量(n)和加入溶液 B 的体积(V)关系如图。

(1)当加入 B 溶液 110mL 时,溶液中的沉淀为_____(填化学式,下同),溶液中的杂质是____________________。
(2)从 90mL 至 100 mL 之间加入 10mL B 溶液时发生的离子反应方程式______。
(3)将 A、B 溶液中各溶质的物质的量浓度填入下表
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c(mol/L) | ___________ | ___________ | ___________ | ___________ | ___________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿 (主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
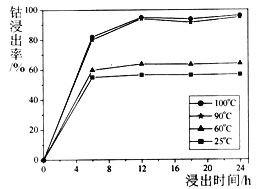
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为______、______;滤渣①的主要成分为_______。
(2) Co2O3与浓硫酸反应生成CoSO4的化学方程式为_________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12离子方程式为____________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11, Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率=![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现节能减排,氯碱工业中相关物料的传输与转化关系如下图所示(电极均为惰性电极,图中未标出)。下列说法中正确的是
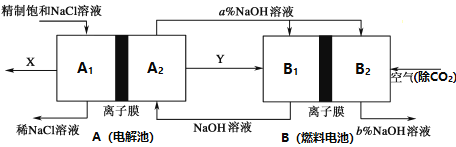
A. A1区域为阴极区,电解过程中,溶液pH增大
B. B2区域中发生的电极反应为O2+4e-+4H+=2H2O
C. 若两池中所用离子膜类型相同,则a<b
D. 利用整套装置最终获得的产品是氢气、氧气和烧碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com