
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿 (主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
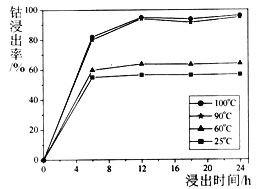
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为______、______;滤渣①的主要成分为_______。
(2) Co2O3与浓硫酸反应生成CoSO4的化学方程式为_________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12离子方程式为____________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11, Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率=![]() )。
)。
【答案】 12h 90℃ SiO2(二氧化硅) 2Co2O3+4H2SO4(浓)![]() 4CoSO4+4H2O+O2↑ 2Na++6Fe3++4SO42-+12H2O
4CoSO4+4H2O+O2↑ 2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12↓+12H+ 2.0×10-5(mol·L-1) -1 Cu2S、S NiSO4
Na2Fe6(SO4)4(OH)12↓+12H+ 2.0×10-5(mol·L-1) -1 Cu2S、S NiSO4 
【解析】考查化学反应原理的综合应用,(1)根据钴的浸出率随酸浸时间、温度的变化关系,推出在12h、90℃时钴的浸出率最高;根据水钴矿的成分,SiO2是酸性氧化物,不与酸反应,即滤渣①的主要成分是SiO2;(2)Co2O3中Co的化合价由+3价→+2价,化合价降低,应该是O元素被氧化成O2,因此反应方程式为2Co2O3+4H2SO4(浓) ![]() 4CoSO4+4H2O+O2↑;(3)根据生成黄钠铁矾,推出离子反应方程式为2Na++6Fe3++4SO42-+12H2O=Na2Fe6(SO4)4(OH)12↓+12H+;(4)
4CoSO4+4H2O+O2↑;(3)根据生成黄钠铁矾,推出离子反应方程式为2Na++6Fe3++4SO42-+12H2O=Na2Fe6(SO4)4(OH)12↓+12H+;(4) ,c(Mg2+)=10-5mol·L-1代入公式,求出c(Ca2+)=2.0×10-5;(5)还原产物是氧化剂被还原得出的物质,根据化学反应方程式,CuSO4中Cu的化合价由+2价→+1价,化合价降低,Na2S2O3中一部分S的化合价降低,转化成S和Cu2S中的S,即还原产物是Cu2S和S;(6)根据流程的目的,以及主要成分,推出水相①中含有溶质为Na2SO4和NiSO4;(7)根据产率的公式,得出钴的产率为
,c(Mg2+)=10-5mol·L-1代入公式,求出c(Ca2+)=2.0×10-5;(5)还原产物是氧化剂被还原得出的物质,根据化学反应方程式,CuSO4中Cu的化合价由+2价→+1价,化合价降低,Na2S2O3中一部分S的化合价降低,转化成S和Cu2S中的S,即还原产物是Cu2S和S;(6)根据流程的目的,以及主要成分,推出水相①中含有溶质为Na2SO4和NiSO4;(7)根据产率的公式,得出钴的产率为 。
。


科目:高中化学 来源: 题型:
【题目】在容积为1120mL的烧瓶里充满NO2和O2的混合气体,然后将其倒扣于水槽中,可以看到液体充满烧瓶(气体体积已折算成标况下的体积),下列说法正确的是
A. NO2与O2的体积分别为896mL和224mL
B. 总反应式:NO2+O2+H2O=HNO3
C. 转移的电子数为0.02mol
D. 有NO气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体可能含有 Ba2+、NH4 + 、Cu2+、Na +、Cl -、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验:
(1)一份固体溶于水得到无色透明溶液。加入足量的 BaCl2 溶液,得到沉淀 6.63g;在沉淀中加入过量 的稀盐酸,仍有 4.66g 沉淀。
(2)另一份固体与过量的 NaOH 固体混合后充分加热,产生气体 1.344L(标准状况)。已知NH4 + OH-=NH3↑H2O ,则下列说法正确的是( )
A. 该固体中一定只含有 NH4 + 、CO32-、SO42-
B. 该固体中一定没有Cu2+、Na +、Ba2+、Cl-
C. 该固体中一定含有NH4 + 、Na +、Cl -、CO32-、SO42-
D. 若该固体中含有 Na+,则一定含有 Cl-,且二者等量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液。它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应。在该反应中,对铁的叙述错误的是( )
A. 铁发生还原反应B. 铁发生氧化反应
C. 铁是还原剂D. 铁失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是( )
A.②③④B.②③C.①②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种粒子中,半径按由大到小的排列顺序是( )
①基态X的原子结构示意图: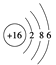 ②基态Y的价电子排布式:3s23p5
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图:![]()
④W基态原子有2个能层,电子式: ![]()
A. ③>①>②>④ B. ③>②>①>④ C. ①>③>④>② D. ①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Fe3+、Cl-、SO42-四种离子,已知Na+、Fe3+、Cl-的个数比为3∶2∶1。则溶液中Fe3+和SO42-的个数比为
A. 1∶2 B. 1∶4 C. 3∶4 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等.则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A.2:3
B.3:2
C.1:2
D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg。下列说法正确的是

A. Pt上发生氧化反应
B. Pb上发生的电极反应式为Pb-2e-+2OH-=Pb(OH)2
C. 反应过程中转移OH-的物质的量为0.25bmol
D. 待测气体中氧气的体积分数为0.7b/a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com