
【题目】下列四种粒子中,半径按由大到小的排列顺序是( )
①基态X的原子结构示意图: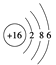 ②基态Y的价电子排布式:3s23p5
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图:![]()
④W基态原子有2个能层,电子式: ![]()
A. ③>①>②>④ B. ③>②>①>④ C. ①>③>④>② D. ①>④>③>②
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,正确的是

A. 装置①不可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClcxH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 45,用浓度为 0.08000molL1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTACu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl23H2O B. Cu2(OH)3ClH2O
C. Cu(OH)Cl2H2O D. Cu2(OH)Cl33H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,原子半径依次增大。W、X在同一主族,Y元素在第三周期中离子半径最小,Y和Z的原子序数之和是W的3倍。下列说法正确的是
A. X的简单氢化物的热稳定性比W的强 B. X的氧化物对应的水化物是强酸
C. Z和W形成的化合物可能含有非极性键 D. Z、Y的氧化物是常用的耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
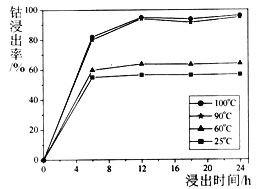
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿 (主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为______、______;滤渣①的主要成分为_______。
(2) Co2O3与浓硫酸反应生成CoSO4的化学方程式为_________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12离子方程式为____________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11, Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率=![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
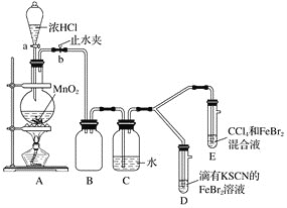
(1)①装置A中发生反应的离子方程式是____________________。
②整套实验装置存在一处明显的不足,请指出__________________。
(2)用改正后的装置进行实验,实验过程如下:_______。
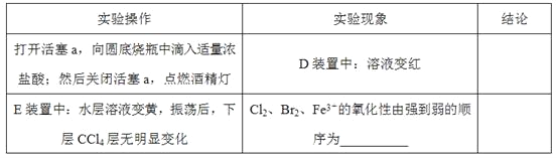
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是

A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与NO2-、NO3-的反应。
实验I | 试剂 | 现象 | |
滴管 | 试管 | ||
2mL | 1 mol·L-1FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
1 mol·L-1NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 | ||
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+![]() Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
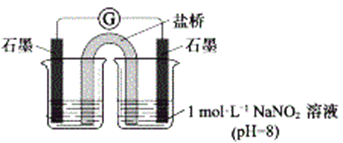
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com