
【题目】碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClcxH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 45,用浓度为 0.08000molL1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTACu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl23H2O B. Cu2(OH)3ClH2O
C. Cu(OH)Cl2H2O D. Cu2(OH)Cl33H2O
【答案】B
【解析】
根据物质中的电荷守恒、原子守恒等原理分析解答;根据物质的量相关计算分析解答。
根据AgCl的质量为 0.1722g,可得到
n(Cl-)=n(AgCl)×![]() =
=![]() ×
×![]() =4.800×10-3mol,
=4.800×10-3mol,
由于滴定原理为:Cu2++EDTA═EDTACu2+,
可得到n(Cu2+)=n(EDTA)×![]() =0.08000mol·L-1×30.00mL×10-3L·mL-1×
=0.08000mol·L-1×30.00mL×10-3L·mL-1×![]() =9.600×10-3mol,
=9.600×10-3mol,
再根据原子守恒原理,可推断出n(OH-),即n(OH-) +n(Cl-)=2n(Cu2+),
所以2×9.600×10-3mol= n(OH-) +4.800×10-3mol,n(OH-)=1.440×10-2mol,
最后根据质量守恒,推断出
m(Cl-)=4.800×10-3mol×35.5g·mol-1=0.1704g,
m(Cu2+)=9.600×10-3mol×64g·mol-1=0.6144g,
m(OH-)=1.440×10-2mol×17g·mol-1=0.2448g,
n(H2O)=![]() =4.800×10-3mol,
=4.800×10-3mol,
可得到a∶b∶c∶x=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1,化学式为Cu2(OH)3Cl·H2O,故B正确;
故选B。


科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如下图所示。下列说法正确的是( )

A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所表示的方法研究金属钠与水反应的性质,其中A是用带孔的铝箔包着的小块的金属钠.

(1)从大块钠上取下的小块钠要用滤纸擦一擦,这样做的目的是_______________。
(2)包裹钠块的铝箔要预先扎上足够多的小孔,若孔数不够,可能出现的不良后果是__________.假如在实验刚开始就将镊子松开拿出水面,A表现出的现象是 _______________________,出现这种现象的原因是______________。
(3)据预测,钠与水反应生成氢气和氢氧化钠.
证明生成氢氧化钠的实验方法和相应的现象是______________________;
(4)已知反应结束后铝箔和钠均消失,请写出相关反应的离子方程式:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
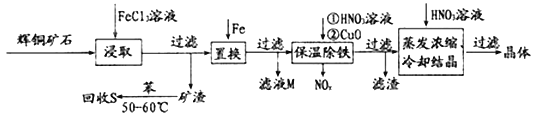
(1)“浸取”时,为了提高浸取速率可采取的措施有___________________________(任写一点)。写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_____________________________________。
(2)“保温除铁”过程中,加入CuO的目的是_________________________________________;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________________。向“滤液M”中加入(或通入)_____ (填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“回收S”过程中温度控制在50 ~60℃之间,不宜过高或过低的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体可能含有 Ba2+、NH4 + 、Cu2+、Na +、Cl -、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验:
(1)一份固体溶于水得到无色透明溶液。加入足量的 BaCl2 溶液,得到沉淀 6.63g;在沉淀中加入过量 的稀盐酸,仍有 4.66g 沉淀。
(2)另一份固体与过量的 NaOH 固体混合后充分加热,产生气体 1.344L(标准状况)。已知NH4 + OH-=NH3↑H2O ,则下列说法正确的是( )
A. 该固体中一定只含有 NH4 + 、CO32-、SO42-
B. 该固体中一定没有Cu2+、Na +、Ba2+、Cl-
C. 该固体中一定含有NH4 + 、Na +、Cl -、CO32-、SO42-
D. 若该固体中含有 Na+,则一定含有 Cl-,且二者等量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管 D 的质量为 86.4g;
③准确称得 6g 纯碱样品放入容器 b 中;
④打开分液漏斗 a 的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管 A 中缓缓鼓入空气数分钟,然后称得干燥管 D 的总质量为 88.6g。 试回答:
(1)鼓入空气的目的是_____,装置 A 中试剂 X 应选用_____;
(2)若④、⑤两步的实验操作太快,则会导致测定结果_____(填“偏大”或“偏小”)
(3)若没有 C 装置,则会导致测定结果_____(填“偏大”或“偏小”)
(4)根据实验中测得的有关数据,计算出纯碱样品 Na2CO3 的质量分数为_____;
(5)本实验设计是否存在问题_____(填“是”或“否”),若存在,改进措施为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液。它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应。在该反应中,对铁的叙述错误的是( )
A. 铁发生还原反应B. 铁发生氧化反应
C. 铁是还原剂D. 铁失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种粒子中,半径按由大到小的排列顺序是( )
①基态X的原子结构示意图: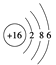 ②基态Y的价电子排布式:3s23p5
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图:![]()
④W基态原子有2个能层,电子式: ![]()
A. ③>①>②>④ B. ③>②>①>④ C. ①>③>④>② D. ①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇钡铜氧(YBa2Cu3O7-x)类高温超导材料(其中Y显+3价,Cu显+2、+3价)可由Y2(CO3)3、BaCO3和CuCO3混合在高温下反应制得。回答下列问题:
(1)Y(钇)是一种稀土金属元素,与Sc(钪)同族相邻。X在元素周期表中的位置是_______,目前的周期表中,该族共有______种元素。
(2)基态Cu3+的电子排布式为________。铜有CuO和Cu2O两种氧化物,后者比前者热稳定性强,原因是____________________________________。
(3) CO32-中C原子釆取_______杂化;第一电离能:C_____O(填“>”或“<”)。
(4)某种钇钡铜氧材料中x=0.2,则n(Cu3+):n(Cu2+)=________。
(5)如图是另一种钇钡铜氧超导材料的晶胞结构示意图,其化学式为______,晶体中Y3+的坐标是______;若其摩尓质量为Mg·mol-1,阿伏加徳罗常数的值为NA,则该晶体的密度为____g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com