
【题目】自然界中含锰元素的主要矿物有软锰矿(MnO2·xH2O)、黑锰矿Mn3O4,大洋底部有大量锰结核矿。锰元素在多个领域中均有重要应用,用于制合金,能改善钢的抗冲击性能等。
(1)Mn在元素周期表中位于___区,核外电子占据最高能层的符号是___,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“___理论”解释。
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为__。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__。
(4)二价锰的化合物MnO和MnS熔融态均能导电,熔点MnO___MnS(选填“高于”、“等于”、“低于”)并解释原因___。
(5)某锰氧化物的晶胞结构如图:
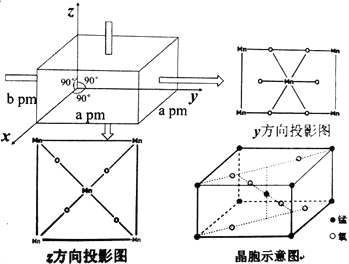
该锰的氧化物的化学式为___,该晶体中Mn的配位数为____,该晶体中Mn之间的最近距离为___pm(用a、b来表示)。
【答案】d N 电子气 A 6 “头碰头” 高于 均为离子晶体,O2-半径比S2-半径小,MnO晶格能大,熔点高 MnO2 6 ![]()
【解析】
(1)Mn是25号元素,原子核外电子排布式是1s22s22p63s23p63d54s2;锰可导电,导热,具有金属光泽,有延展性,是因为有自由电子,这些性质都可以用“电子气理论”解释;
(2)A.Mn3+在水溶液中容易歧化为MnO2和Mn2+,说明Mn3+不稳定;
B.Mn2+中价电子层不含成对电子,但是内层中含有成对电子;
C.第四周期中价电子层中未成对电子数最多的元素价电子排布式为:3d54s1;
D.Mn2+与Fe3+具有相同的价电子构型,微粒的化学性质不仅与价电子构型有关,也和微粒的电荷数、微粒半径、原子序数有关;
(3)MnF62的空间构型是正八面体,则中心原子的价层电子对数为6;F与Mn之间的共价键都是共价单键;
(4)物质都属于离子晶体,离子晶体的阴离子带有相同电荷,离子半径越小,离子键越强,晶格能越大,熔点越高;
(5)用均摊法计算确定化学式,并结合微粒的空间排列确定Mn的配位数;由晶胞结构可知:在该晶胞中距离相等且最近的2个Mn在晶胞体对角线的一半。
(1)Mn是25号元素,原子核外电子排布式是1s22s22p63s23p63d54s2,可知M在元素周期表中位于第四周期第VIIB,属于d区元素,核外电子占据最高能层的符号是N;锰可导电,导热,具有金属光泽,有延展性,是因为有自由电子,这些性质都可以用“电子气理论”解释,故答案为:d;N;电子气;
(2)A.Mn3+的价电子构型为3d4,Mn3+在水溶液中容易歧化为MnO2和Mn2+,说明Mn3+不稳定,Mn3+容易变成电子半充满的稳定的价电子构型为3d5,3d4则属于不稳定的电子构型,故A正确;
B.Mn2+中价电子层不含成对电子,但是内层中含有成对电子,故B错误;
C.第四周期中价电子层中未成对电子数最多的元素价电子排布式为:3d54s1,是Cr元素,故C错误;
D.Mn2+与Fe3+具有相同的价电子构型,微粒的化学性质不仅与价电子构型有关,也和微粒的电荷数、微粒半径、原子序数有关,因此它们的化学性质不相似,Mn2+具有强的还原性,而Fe3+具有强的氧化性,故D错误;
故答案选:A;
(3)MnF62的空间构型是正八面体,则中心原子的价层电子对数为6.在化合物化合物K2MnF6中含有的F与Mn之间的共价键都是共价单键,属于σ键,在形成过程中原子轨道的重叠方式为“头碰头”,故答案为:6;“头碰头”;
(4)MnO和MnS都是离子晶体,离子电荷数相同,O2离子半径小于S2的离子半径,MnO的晶格能大,熔点更高,故答案为:高于;均为离子晶体,O2-半径比S2-半径小,MnO晶格能大,熔点高;
(5)在该晶体中含有的Mn原子个数为:![]() ×8+1=2,含有的O原子数目为:
×8+1=2,含有的O原子数目为:![]() ×4+2=4,Mn:O=2:4=1:2,所以该锰的氧化物的化学式为MnO2;根据晶胞投影图可知:在该晶体体中与Mn原子距离相等且最近的O原子有6个,所以Mn的配位数为6;由晶胞结构可知:在该晶胞中距离相等且最近的2个Mn在晶胞体对角线的一半,晶胞的体对角线为
×4+2=4,Mn:O=2:4=1:2,所以该锰的氧化物的化学式为MnO2;根据晶胞投影图可知:在该晶体体中与Mn原子距离相等且最近的O原子有6个,所以Mn的配位数为6;由晶胞结构可知:在该晶胞中距离相等且最近的2个Mn在晶胞体对角线的一半,晶胞的体对角线为![]() pm,所以该晶体中Mn之间的最近距离为
pm,所以该晶体中Mn之间的最近距离为![]() ×
×![]() pm=
pm=![]() pm,故答案为:MnO2;6;
pm,故答案为:MnO2;6;![]() 。
。


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是

A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体之间的反应有其独特的优点,对其研究具有重要意义。
(1)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。

在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__。
A.H2的消耗速率是CH3OH生成速率的2倍
B. CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
(2)CO(g)+2H2(g)![]() CH3OH(g)在__(填“低温”、“高温”或“任意温度”)下能自发进行。
CH3OH(g)在__(填“低温”、“高温”或“任意温度”)下能自发进行。
(3)化学平衡常数K(B)、K(C)、K(D)的大小关系是:_。
(4)计算图中A点的平衡常数Kp=__。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
(5)已知NH3(g)+NOx(g)+O2(g)![]() N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
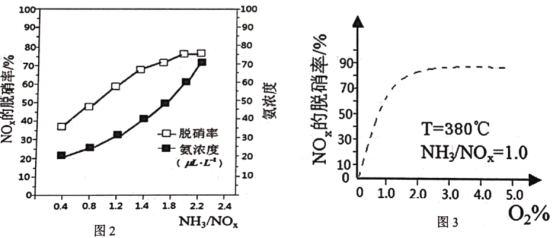 ①图2中,最佳氨氮比为2.0,理由是__。
①图2中,最佳氨氮比为2.0,理由是__。
②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)用蒸馏水稀释0.10mol/L的醋酸,则下列各式表示的数值随水量的增加而增大的是_____;
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 20 ℃时,某气态烃与氧气混合,装入密闭容器中,点燃爆炸后,又恢复到 20 ℃, 此时容器内气体的压强为反应前的一半,经 NaOH 溶液吸收后,容器内几乎成真空,此 烃的分子式可能是( )
A.CH4B.C2H6C.C3H6D.C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用现代科技从苦艾精油中分离出多种化合物,其中四种的结构如下:
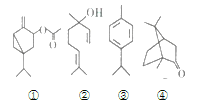
下列说法不正确的是( )
A.②③分子中所有碳原子不可能处于同一平面内
B.②④互为同分异构体
C.④的一氯代物有6种
D.①②③均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)的别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,有芳香气味,用于配制香水、香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为: ![]() +CH3CH2OH
+CH3CH2OH![]()
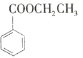 +H2O
+H2O
已知:苯甲酸在100℃会迅速升华。相关有机物的性质如表所示。
名称 | 相对分子质量 | 颜色、状态 | 沸点/℃ | 密度/(g﹒cm-3) |
苯甲酸 | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在圆底瓶中加入12.20g苯甲酸,25mL95%的乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装置装好仪器,控制温度在65~70℃加热回流2h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。

②反应结束,打开旋塞放出分水器中的液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。用分液漏斗分出有机层,水层用25mL乙醚,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是________(填序号)。
A. 25mL B.50mL C. 100mL D. 250mL
(2)步骤①中使用分水器不断分离除去水的目的是___________。
(3)步骤②中应控制蒸馏的温度为_______(填序号)。
A. 65~70℃ B. 78~80℃ C. 80~85℃ D. 215~220℃
(4)步骤③加入Na2CO3的作用是_______;若Na2CO3的加入量不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________。
(5)关于步骤③中的萃取分液操作的叙述正确的是__________(填序号)。
A. 水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B. 振摇几次后需打开分液漏斗上口的玻璃塞放气
C. 经几次振摇并放气后,手持分液漏斗静置待液体分层
D. 放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算可得本实验的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图有关图象,说法正确的是( )
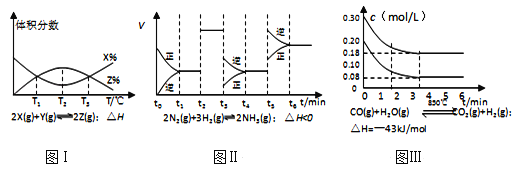
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应体系温度的措施
D. 图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为 H+和 OH-,并实现其定向通过。下列说法不正确的是

A.该装置将光能转化为化学能并分解水
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应: 2V2+ +2H2O  2V3++2OH-+H2↑
2V3++2OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com