
【题目】气体之间的反应有其独特的优点,对其研究具有重要意义。
(1)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。

在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__。
A.H2的消耗速率是CH3OH生成速率的2倍
B. CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
(2)CO(g)+2H2(g)![]() CH3OH(g)在__(填“低温”、“高温”或“任意温度”)下能自发进行。
CH3OH(g)在__(填“低温”、“高温”或“任意温度”)下能自发进行。
(3)化学平衡常数K(B)、K(C)、K(D)的大小关系是:_。
(4)计算图中A点的平衡常数Kp=__。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
(5)已知NH3(g)+NOx(g)+O2(g)![]() N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
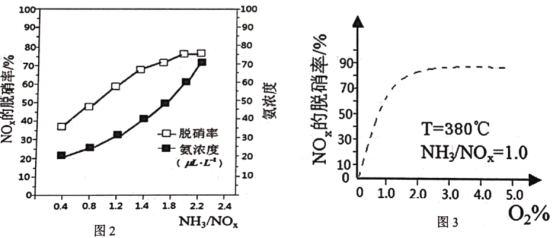 ①图2中,最佳氨氮比为2.0,理由是__。
①图2中,最佳氨氮比为2.0,理由是__。
②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示__。
【答案】BCD 低温 K(B)>K(C) = K(D) ![]() 氨氮比为2.0到2.2,脱硝率变化不大,但氨浓度增加较大,导致成产成本增多,低于2.0时,脱硝率随氨氮比增加而明显增大
氨氮比为2.0到2.2,脱硝率变化不大,但氨浓度增加较大,导致成产成本增多,低于2.0时,脱硝率随氨氮比增加而明显增大 
【解析】
⑴A. H2的消耗速率,正向进行,CH3OH生成速率,正向进行,同一个方向,因此不能说明达到平衡;B. CH3OH的体积分数不再改变,说明达到平衡;C. 密度等于气体质量除以容器体积,正向反应,气体质量不变,容器体积减小,密度不断减小,当混合气体的密度不再改变,则达到平衡;D. CO和CH3OH的物质的量之比保持不变,则说明达到平衡。
⑵判断反应ΔH,ΔS,根据ΔG = ΔHΔS<0判断。
⑶C、D温度相同,平衡常数相等,B温度比C温度低,判断K(B)、K(C)大小。
⑷根据温度相同,平衡常数相同,A点平衡常数与E点平衡常数相同,建立三段式算E点平衡常数。
⑸①根据图中信息氨氮比进行分析。
②使用催化剂与不使用,主要是反应速率加快,转化率不变,。
⑴A. H2的消耗速率,正向进行,CH3OH生成速率,正向进行,同一个方向,因此不能说明达到平衡,故A不符合题意;B. CH3OH的体积分数不再改变,说明达到平衡,故B符合题意;C. 密度等于气体质量除以容器体积,正向反应,气体质量不变,容器体积减小,密度不断减小,当混合气体的密度不再改变,则达到平衡,故C符合题意;D. CO和CH3OH的物质的量之比保持不变,则说明达到平衡,故D符合题意;综上所述,答案为BCD。
⑵从C点到A点,温度降低,转化率升高,平衡正向移动,降温向放热反应移动即正向放热反应,反应是体积减小反应ΔS <0,因此根据ΔG = ΔHΔS<0,得出CO(g)+2H2(g)![]() CH3OH(g)在在低温下能自发进行;故答案为:低温。
CH3OH(g)在在低温下能自发进行;故答案为:低温。
⑶C、D温度相同,K(C) = K(D),B温度比C温度低,反应是放热反应,因此降温正向移动,平衡常数增大,即K(B)>K(C),所以化学平衡常数K(B)、K(C)、K(D)的大小关系是:K(B)>K(C) = K(D)。
⑷根据温度相同,平衡常数相同,A点平衡常数与E点平衡常数相同,因此E点CO转化率为80%,则 ,因此E点的平衡常数
,因此E点的平衡常数 ,A点和E一样,故答案为:
,A点和E一样,故答案为:![]() 。
。
⑸①图2中,根据图中信息氨氮比为2.0到2.2,脱硝率变化不大,但氨浓度增加较大,因此增加成本较多,低于2.0时,脱硝率随氨氮比增加而明显增大,所以最佳氨氮比为2.0;故答案为:氨氮比为2.0到2.2,脱硝率变化不大,但氨浓度增加较大,导致成产成本增多,低于2.0时,脱硝率随氨氮比增加而明显增大。
②请在图3中,使用催化剂与不使用,主要是反应速率加快,转化率不变,因此用实线画出不使用催化剂情况下的图示与原来是一致的,只是把虚线变为实线,如图。
 ;故答案为:
;故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g)CO2(g)+NO(g)应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
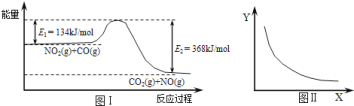
下列有关说法正确的是
A.一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234kJ热量
B.若X表示温度,则Y表示的可能是CO2的物质的量浓度
C.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
D.若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为“现代金属”和“战略金属”。
(1)Ti基态核外电子排布式为___。
(2)TiO2与BaCO3一起熔融可制得偏钛酸钡,CO32-的空间构型为___;与CO32-互为等电子体的分子是___。
(3)四异丙醇钛(C12H28O4Ti)结构如图-1所示,1mol四异丙醇钛中含有σ键的数目为___mol。
(4)偏钛酸钡的晶体结构如图-2所示,则偏钛酸钡的化学式为___;与Ba2+最近且等距离的O2-为___个。
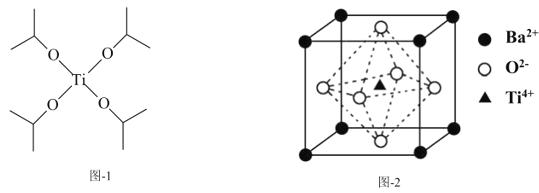
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素 A、B、C、D、E 的原子序数依次增大,A 元素原子的核外电子只有一种运动状 态;基态 B 原子 s 能级的电子总数比 p 能级的多 1;基态 C 原子和基态 E 原子中成对电子数均是未成对电 子数的 3 倍;D 形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1) E 的元素名称为________。
(2)元素 A、B、C 中,电负性最大的是________(填元素符号,下同),元素 B、C、D 第一电离能由大到小的顺序为________。
(3)与同族其它元素 X 形成的 XA3相比,BA3易液化的原因是________;BA3分子中键角________109°28'(填“>”“<”或“=”),请写出与BA3互为等电子体的一个离子________。
(4)BC3 离子中 B 原子轨道的杂化类型为________,BC3 离子的立体构型为________。
(5)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图 所示)相似。若 DB 的晶胞参数为 a pm,则晶体的密度为________g·cm3(用NA表示阿伏加德罗常数)。
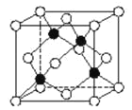
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
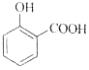 +2HCO3-→
+2HCO3-→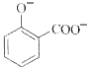 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某淡黄色固体A(仅含三种元素,式量小于160)可用于制药,为探究其组成和性质,设计并完成如下实验:
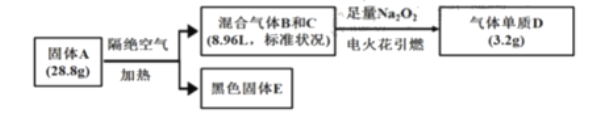
已知:①上述流程中所涉及的反应都充分进行。
②B、C、D均为常见气体。相同情况下气体B的密度大气体C。
③黑色固体![]() 溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
请问答:
(1)写出气体B的电子式__,固体A的化学式是__。
(2)黑色固体E与足量浓硝酸反应的离子反应方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是

A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中含锰元素的主要矿物有软锰矿(MnO2·xH2O)、黑锰矿Mn3O4,大洋底部有大量锰结核矿。锰元素在多个领域中均有重要应用,用于制合金,能改善钢的抗冲击性能等。
(1)Mn在元素周期表中位于___区,核外电子占据最高能层的符号是___,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“___理论”解释。
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为__。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__。
(4)二价锰的化合物MnO和MnS熔融态均能导电,熔点MnO___MnS(选填“高于”、“等于”、“低于”)并解释原因___。
(5)某锰氧化物的晶胞结构如图:
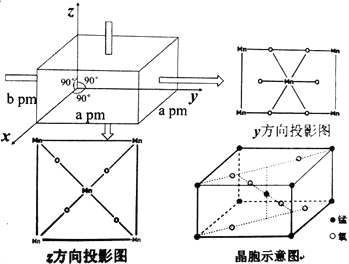
该锰的氧化物的化学式为___,该晶体中Mn的配位数为____,该晶体中Mn之间的最近距离为___pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列有关水溶液的问题:
(1)下列两种溶液中,室温下由水电离生成的H+浓度之比(①:②)是________
①pH=1的盐酸 ②0.01 mol/L的NaOH溶液
(2)已知水在25℃和95℃时, 水的电离平衡曲线如图所示:
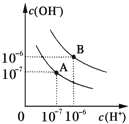
①在25℃时, 水的电离平衡曲线应为____(填“A"或“B");95℃时水的离子积 Kw=_____
②25℃时,将pH=9的Ba(OH)2溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则Ba(OH)2溶液与H2SO4溶液的体积比为________
③曲线B对应温度下,pH=2的盐酸溶液和pH=11的氢氧化钠溶液按体积比9:1混合,溶液的pH=_____
④ 常温下,将一小块金属钠投入100mL0.15mol/L的CuCl2溶液中,收集到产生气体的体积为1.456L(标准状况下),此时溶液体积仍为100mL,反应后溶液的pH=____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com