
°æƒø°øƒ≥µ≠ª∆…´πÃÃÂA£®Ωˆ∫¨»˝÷÷‘™Àÿ£¨ Ω¡ø–°”⁄160£©ø…”√”⁄÷∆“©£¨Œ™ÃΩæø∆‰◊È≥…∫Õ–‘÷ £¨…˺∆≤¢ÕÍ≥…»Áœ¬ µ—È£∫
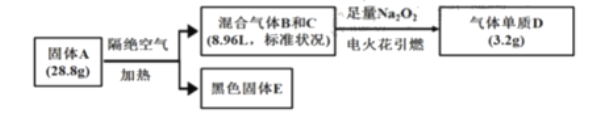
“—÷™£∫¢Ÿ…œ ˆ¡˜≥Ã÷–À˘…ʺ∞µƒ∑¥”¶∂º≥‰∑÷Ω¯––°£
¢⁄B°¢C°¢Dæ˘Œ™≥£º˚∆¯Ã°£œýÕ¨«Èøˆœ¬∆¯ÃÂBµƒ√Ð∂»¥Û∆¯ÃÂC°£
¢€∫⁄…´πÃÃÂ![]() »Ð”⁄—ŒÀ·∫ÛµŒº”KSCN£¨ŒÞ√˜œ‘œ÷œÛ£¨º” ¡ø¬»ÀÆ∫Û£¨»Ð“∫±‰∫Ï°£
»Ð”⁄—ŒÀ·∫ÛµŒº”KSCN£¨ŒÞ√˜œ‘œ÷œÛ£¨º” ¡ø¬»ÀÆ∫Û£¨»Ð“∫±‰∫Ï°£
«ÎŒ ¥£∫
£®1£©–¥≥ˆ∆¯ÃÂBµƒµÁ◊” Ω__£¨πÃÃÂAµƒªØ—ß Ω «__°£
£®2£©∫⁄…´πÃÃÂE”Î◊„¡ø≈®œıÀ·∑¥”¶µƒ¿Î◊”∑¥”¶∑Ω≥Ã Ω «__°£
°æ¥∞∏°ø![]() FeC2O4 3FeO + 10H+ + NO3£≠ = NO + 3Fe3+ + 5H2O
FeC2O4 3FeO + 10H+ + NO3£≠ = NO + 3Fe3+ + 5H2O
°æΩ‚Œˆ°ø
B°¢C°¢Dæ˘Œ™≥£º˚∆¯ÃÂÀµ√˜Dµ•÷ Œ™—ı∆¯£¨ŒÔ÷ µƒ¡øŒ™![]() £¨œýÕ¨«Èøˆœ¬∆¯ÃÂBµƒ√Ð∂»¥Û∆¯ÃÂC‘ÚÀµ√˜BŒ™∂˛—ıªØú£¨B”Îπ˝—ıªØƒ∆∑¥”¶£¨‘ÚCŒ™“ª—ıªØú£¨∆¯ÃÂŒÔ÷ µƒ¡øŒ™
£¨œýÕ¨«Èøˆœ¬∆¯ÃÂBµƒ√Ð∂»¥Û∆¯ÃÂC‘ÚÀµ√˜BŒ™∂˛—ıªØú£¨B”Îπ˝—ıªØƒ∆∑¥”¶£¨‘ÚCŒ™“ª—ıªØú£¨∆¯ÃÂŒÔ÷ µƒ¡øŒ™![]() ”…”⁄…˙≥…0.1mol—ı∆¯£¨∏˘æð2CO2 + 2Na2O2 = 2Na2CO3 + O2£¨“Ú¥À∂˛—ıªØúµƒŒÔ÷ µƒ¡øŒ™0.2mol£¨COŒÔ÷ µƒ¡øŒ™0.2mol£¨∫⁄…´πÃÃÂE»Ð”⁄—ŒÀ·∫ÛµŒº”KSCN£¨ŒÞ√˜œ‘œ÷œÛ£¨Àµ√˜ŒÞÃ˙¿Î◊”£¨º” ¡ø¬»ÀÆ∫Û£¨»Ð“∫±‰∫Ï£¨Àµ√˜‘≠ŒÔ÷ Œ™FeO£¨‘Úm(FeO) = 28.8g0.2mol°¡28 gmol1 0.2mol°¡44 gmol1 = 14.4g£¨‘ÚFeOŒÔ÷ µƒ¡ø
”…”⁄…˙≥…0.1mol—ı∆¯£¨∏˘æð2CO2 + 2Na2O2 = 2Na2CO3 + O2£¨“Ú¥À∂˛—ıªØúµƒŒÔ÷ µƒ¡øŒ™0.2mol£¨COŒÔ÷ µƒ¡øŒ™0.2mol£¨∫⁄…´πÃÃÂE»Ð”⁄—ŒÀ·∫ÛµŒº”KSCN£¨ŒÞ√˜œ‘œ÷œÛ£¨Àµ√˜ŒÞÃ˙¿Î◊”£¨º” ¡ø¬»ÀÆ∫Û£¨»Ð“∫±‰∫Ï£¨Àµ√˜‘≠ŒÔ÷ Œ™FeO£¨‘Úm(FeO) = 28.8g0.2mol°¡28 gmol1 0.2mol°¡44 gmol1 = 14.4g£¨‘ÚFeOŒÔ÷ µƒ¡ø![]() £¨“Ú¥Àn(Fe): n(C): n(O) = 0.2mol:(0.2mol+0.2mol):(0.2mol+0.2mol+0.2mol°¡2) =1:2:4£¨‘ÚªØ—ß ΩŒ™FeC2O4°£
£¨“Ú¥Àn(Fe): n(C): n(O) = 0.2mol:(0.2mol+0.2mol):(0.2mol+0.2mol+0.2mol°¡2) =1:2:4£¨‘ÚªØ—ß ΩŒ™FeC2O4°£
¢≈∆¯ÃÂBŒ™∂˛—ıªØú£¨∆‰µÁ◊” Ω![]() £¨∏˘æð…œ√Ê∑÷Œˆµ√µΩπÃÃÂAµƒªØ—ß Ω «FeC2O4£ªπ ¥∞∏Œ™£∫
£¨∏˘æð…œ√Ê∑÷Œˆµ√µΩπÃÃÂAµƒªØ—ß Ω «FeC2O4£ªπ ¥∞∏Œ™£∫![]() £ªFeC2O4°£
£ªFeC2O4°£
¢∆∫⁄…´πÃÃÂEº¥FeO”Î◊„¡ø≈®œıÀ·∑¥”¶…˙≥…œıÀ·Ã˙°¢“ª—ıªØµ™∫ÕÀÆ£¨∆‰¿Î◊”∑¥”¶∑Ω≥Ã Ω «3FeO + 10H+ + NO3£≠ = NO + 3Fe3+ + 5H2O£ªπ ¥∞∏Œ™£∫3FeO + 10H+ + NO3£≠ = NO + 3Fe3+ + 5H2O°£


 ±∏’Ω÷–øº∫ƺŸœµ¡–¥∞∏
±∏’Ω÷–øº∫ƺŸœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø “Œ¬œ¬£¨œ¬¡–»Ð“∫÷–¡£◊”µƒŒÔ÷ µƒ¡ø≈®∂»πÿœµ’˝»∑µƒ «
A.0.1mol/L NaHS»Ð“∫£∫c(H+)£´c(Na+)=c(S2-)£´c(HS-)£´c(OH-)
B.0.1mol/L Na2CO3»Ð“∫£∫c(H2CO3)£´c(HCO3-)£´c(CO32-)=0.2 mol/L
C.≈®∂»æ˘Œ™0.1 mol/Lµƒ ¢Ÿ NH4Cl ¢⁄NH4Al(SO4)2 ¢€ NH4HCO3»˝÷÷»Ð“∫£¨∆‰÷–c(NH4+)£∫¢⁄£æ¢Ÿ£æ¢€
D.pH=11µƒNaOH»Ð“∫”ÎpH =3µƒCH3COOH»Ð“∫µ»Ãª˝ªÏ∫œ£∫c(Na+)£æc(CH3COO-)£æc(OH-)£æc(H+)
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¬»ý≠ «∫œ≥…“ª÷÷“÷÷∆≤°∂æ“©ŒÔµƒ÷–º‰Ã£¨∆‰∫œ≥…¬∑œþ»ÁÕº£∫
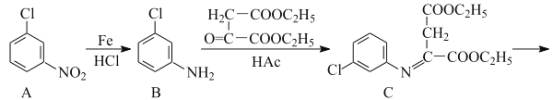
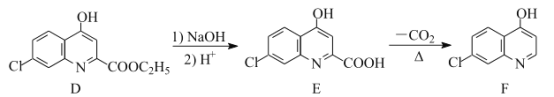
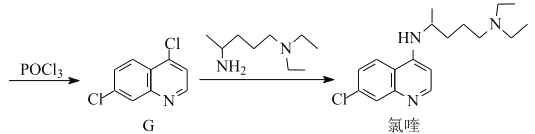
£®1£©D÷–∫¨—ıπŸƒÐÕ≈µƒ√˚≥∆Œ™___∫Õ___°£
£®2£©A°˙Bµƒ∑¥”¶¿ý–ÕŒ™___°£
£®3£©C°˙Dµƒ∑¥”¶÷–”–∏±≤˙ŒÔX£®X”ÎDª•Œ™Õ¨∑÷“Ïππã©…˙≥…£¨–¥≥ˆXµƒΩ·ππºÚ Ω£∫
___°£
£®4£©Eµƒ“ª÷÷Õ¨∑÷“ÏππÃÂÕ¨ ±¬˙◊„œ¬¡–Ãıº˛£¨–¥≥ˆ∏√Õ¨∑÷“ÏππõƒΩ·ππºÚ Ω£∫___°£
¢ŸÀ·–‘Ãıº˛œ¬ÀÆΩ‚µ√µΩµƒ¡Ω÷÷”–ª˙≤˙ŒÔ£¨∂ºƒÐ∑¢…˙“¯æµ∑¥”¶£¨∆‰÷–“ª÷÷”ÎFeCl3»Ð“∫∑¢…˙œ‘…´∑¥”¶£ª
¢⁄∑÷◊”÷–”–«Ëª˘£®-CN£©£¨”–“ª∏ˆ ÷–‘ú‘≠◊”£¨”–4÷÷≤ªÕ¨ªØ—ߪ∑æ≥µƒ«‚°£
£®5£©“—÷™£∫¢Ÿ![]() NH2“◊±ª—ıªØ£ª
NH2“◊±ª—ıªØ£ª
¢⁄ı£¬»£®![]() Cl£©µƒ¬»‘≠◊”±»¬»¥˙Ã˛µƒ∏¸“◊±ª»°¥˙
Cl£©µƒ¬»‘≠◊”±»¬»¥˙Ã˛µƒ∏¸“◊±ª»°¥˙
¢€![]() RHC=N-CH2R°Ø
RHC=N-CH2R°Ø
–¥≥ˆ“‘![]() ∫Õ
∫Õ![]() Œ™‘≠¡œ÷∆±∏
Œ™‘≠¡œ÷∆±∏ µƒ∫œ≥…¬∑œþ¡˜≥ÃÕº£®ŒÞª˙ ‘º¡»Œ”√£¨∫œ≥…¬∑œþ¡˜≥ÃÕº æ¿˝º˚±æÂÂ∏…£©___°£
µƒ∫œ≥…¬∑œþ¡˜≥ÃÕº£®ŒÞª˙ ‘º¡»Œ”√£¨∫œ≥…¬∑œþ¡˜≥ÃÕº æ¿˝º˚±æÂÂ∏…£©___°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø‘⁄10L∫„»ð√б’»ð∆˜÷–≥‰»ÎX(g)∫ÕY(g)£¨∑¢…˙∑¥”¶X(g)+Y(g)![]() M(g)+N(g)£¨À˘µ√ µ—È ˝æð»Áœ¬±Ì£∫
M(g)+N(g)£¨À˘µ√ µ—È ˝æð»Áœ¬±Ì£∫
µ—ȱý∫≈ | Œ¬∂»/°Ê | ∆ º ±ŒÔ÷ µƒ¡ø/mol | ∆Ω∫‚ ±ŒÔ÷ µƒ¡ø/mol | |
n(X) | n(Y) | n(M) | ||
¢Ÿ | 700 | 0.40 | 0.10 | 0.090 |
¢⁄ | 800 | 0.10 | 0.40 | 0.080 |
¢€ | 800 | 0.20 | 0.30 | a |
¢Ð | 900 | 0.10 | 0.15 | b |
œ¬¡–Àµ∑®≤ª’˝»∑µƒ «£® £©
A. µ—È¢Ÿ÷–£¨»Ù5minŒ¥≤‚µ√n(M)=0.050mol£¨‘Ú0÷¡5min ±º‰ƒ⁄£¨”√N±Ì 浃∆Ωæ˘∑¥”¶ÀŸv(N)=1.0°¡10-3mol°§L-1°§min-1
B. µ—È¢⁄÷–£¨¥ÔµΩ∆Ω∫‚ ±£¨Yµƒ◊™ªØ¬ Œ™20%
C. µ—È¢€÷–£¨∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝K=1.0
D. µ—È¢Ð÷–£¨¥ÔµΩ∆Ω∫‚ ±£¨ b>0.060
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∆¯ÃÂ÷ƺ‰µƒ∑¥”¶”–∆‰∂¿Ãÿµƒ”≈µ„£¨∂‘∆‰—–æøæþ”–÷ÿ“™“‚“°£
£®1£©‘⁄“ª»ðª˝ø…±‰µƒ√б’»ð∆˜÷–£¨1molCO”Î2molH2∑¢…˙∑¥”¶£∫CO(g)+2H2(g)![]() CH3OH(g)£¨CO‘⁄≤ªÕ¨Œ¬∂»œ¬µƒ∆Ω∫‚◊™ªØ¬ £®¶¡£©”Ηπ«øµƒπÿœµ»ÁÕº1À˘ æ°£
CH3OH(g)£¨CO‘⁄≤ªÕ¨Œ¬∂»œ¬µƒ∆Ω∫‚◊™ªØ¬ £®¶¡£©”Ηπ«øµƒπÿœµ»ÁÕº1À˘ æ°£

‘⁄Bµ„Ãıº˛œ¬£¨œ¬¡–– ˆƒÐÀµ√˜…œ ˆ∑¥”¶ƒÐ¥ÔµΩªØ—ß∆Ω∫‚◊¥Ã¨µƒ «__°£
A.H2µƒœ˚∫ƒÀŸ¬ «CH3OH…˙≥…ÀŸ¬ µƒ2±∂
B. CH3OHµƒÃª˝∑÷ ˝≤ª‘Ÿ∏ƒ±‰
C.ªÏ∫œ∆¯Ãµƒ√Ð∂»≤ª‘Ÿ∏ƒ±‰
D.CO∫ÕCH3OHµƒŒÔ÷ µƒ¡ø÷Ʊ»±£≥÷≤ª±‰
£®2£©CO(g)+2H2(g)![]() CH3OH(g)‘⁄__£®ÃÓ°∞µÕŒ¬°±°¢°∞∏þŒ¬°±ªÚ°∞»Œ“‚Œ¬∂»°±£©œ¬ƒÐ◊‘∑¢Ω¯––°£
CH3OH(g)‘⁄__£®ÃÓ°∞µÕŒ¬°±°¢°∞∏þŒ¬°±ªÚ°∞»Œ“‚Œ¬∂»°±£©œ¬ƒÐ◊‘∑¢Ω¯––°£
£®3£©ªØ—ß∆Ω∫‚≥£ ˝K(B)°¢K(C)°¢K(D)µƒ¥Û–°πÿœµ «£∫_°£
£®4£©º∆À„Õº÷–Aµ„µƒ∆Ω∫‚≥£ ˝Kp=__°£
£®”√∆Ω∫‚∑÷—π¥˙ÃÊ∆Ω∫‚≈®∂»º∆À„£¨∑÷—π=◊Ð—π°¡ŒÔ÷ µƒ¡ø∑÷ ˝£ª”√P1ªÚP2ªÚP3±Ì 棩°£
£®5£©“—÷™NH3(g)+NOx(g)+O2(g)![]() N2(g)+H2O(g)£®Œ¥≈‰∆Ω£©£¨Œ™—–æøNH3—°‘Ò–‘¥þªØªπ‘≠Õ—œıµƒ∑¥”¶Ãıº˛£¨ƒ≥ø∆—––°◊ÈÕ®π˝“ªœµ¡– µ—È£¨µ√≥ˆ∆Ω∫‚ ±µƒÕ—œı¬ ”Î∞±µ™±»µƒπÿœµ[∆‰÷–NH3/NO2±Ì æ∞±µ™±»£¨O2%±Ì æ—ı∆¯∫¨¡ø]°£
N2(g)+H2O(g)£®Œ¥≈‰∆Ω£©£¨Œ™—–æøNH3—°‘Ò–‘¥þªØªπ‘≠Õ—œıµƒ∑¥”¶Ãıº˛£¨ƒ≥ø∆—––°◊ÈÕ®π˝“ªœµ¡– µ—È£¨µ√≥ˆ∆Ω∫‚ ±µƒÕ—œı¬ ”Î∞±µ™±»µƒπÿœµ[∆‰÷–NH3/NO2±Ì æ∞±µ™±»£¨O2%±Ì æ—ı∆¯∫¨¡ø]°£
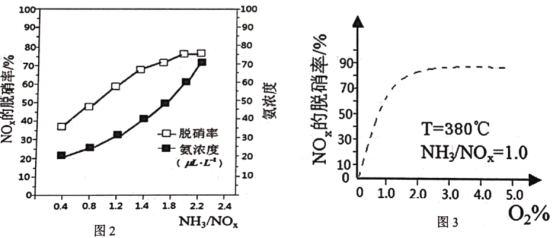 ¢ŸÕº2÷–£¨◊Óº—∞±µ™±»Œ™2.0£¨¿Ì”… «__°£
¢ŸÕº2÷–£¨◊Óº—∞±µ™±»Œ™2.0£¨¿Ì”… «__°£
¢⁄«Î‘⁄Õº3÷–£¨”√ µœþª≠≥ˆ≤ª π”√¥þªØº¡«Èøˆœ¬£®∆‰À˚Ãıº˛ÕÍ»´œýÕ¨£©µƒÕº æ__°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø25°Ê ±£¨œÚ≈®∂»æ˘Œ™0.1mol°§L-1°¢Ãª˝æ˘Œ™100mLµƒ¡Ω÷÷“ª‘™À·HX°¢HY»Ð“∫÷–∑÷±º”»ÎNaOHπÃ㨻Г∫÷–![]() ÀÊn(NaOH)µƒ±‰ªØ»ÁÕºÀ˘ æ°£œ¬¡–Àµ∑®’˝»∑µƒ «
ÀÊn(NaOH)µƒ±‰ªØ»ÁÕºÀ˘ æ°£œ¬¡–Àµ∑®’˝»∑µƒ «

A.HXŒ™»ıÀ·£¨HYŒ™«øÀ·
B.ÀƵƒµÁ¿Î≥Ã∂»£∫b>c>d
C.Cµ„∂‘”¶µƒ»Ð“∫÷–£∫c(HY)>c(Y-)
D.»ÙΩ´cµ„”Îdµ„µƒ»Ð“∫»´≤øªÏ∫œ£¨»Ð“∫÷–¿Î◊”≈®∂»¥Û–°£∫c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø25°Ê ±£¨µÁ¿Î∆Ω∫‚≥£ ˝£∫
ªØ—ß Ω | CH3COOH | H2CO3 | HClO |
µÁ¿Î∆Ω∫‚≥£ ˝ | 1.8°¡10-5 | K1=4.3°¡10-7 K2=5.6°¡10-11 | 3.0°¡10-8 |
£®1£©”√’Ù¡ÛÀÆœ° Õ0.10mol/Lµƒ¥◊À·£¨‘Úœ¬¡–∏˜ Ω±Ì æµƒ ˝÷µÀÊÀÆ¡øµƒ‘ˆº”∂¯‘ˆ¥Ûµƒ «_____£ª
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
£®2£©Ãª˝Œ™10mLpH=2µƒ¥◊À·»Ð“∫”Γª‘™À·HX∑÷±º”ÀÆœ° Õ÷¡1000mL£¨œ° Õπ˝≥ÃpH±‰ªØ»ÁÕº£¨‘ÚHXµƒµÁ¿Î∆Ω∫‚≥£ ˝______(ÃÓ°∞¥Û”⁄°±°¢°∞µ»”⁄°±ªÚ°∞–°”⁄°±)¥◊À·µƒ∆Ω∫‚≥£ ˝£¨œ° Õ∫Û£¨HX»Ð“∫÷–ÀƵÁ¿Î≥ˆ¿¥µƒc(H+)_____¥◊À·»Ð“∫÷–ÀƵÁ¿Î≥ˆ¿¥µƒc(H+)(ÃÓ°∞¥Û”⁄°±°¢°∞µ»”⁄°±ªÚ°∞–°”⁄°±)°£

≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
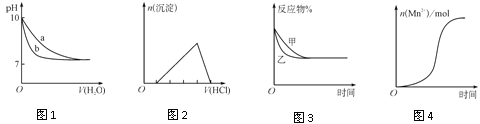
°æƒø°ø‘À”√œ÷¥˙ø∆ºº¥”øý∞¨æ´”Õ÷–∑÷¿Î≥ˆ∂ý÷÷ªØ∫œŒÔ£¨∆‰÷–Àƒ÷÷µƒΩ·ππ»Áœ¬£∫
œ¬¡–Àµ∑®≤ª’˝»∑µƒ «£® £©
A.¢⁄¢€∑÷◊”÷–À˘”–ú‘≠◊”≤ªø…ƒÐ¥¶”⁄Õ¨“ª∆Ω√ʃ⁄
B.¢⁄¢Ðª•Œ™Õ¨∑÷“ÏππÃÂ
C.¢Ðµƒ“ª¬»¥˙ŒÔ”–6÷÷
D.¢Ÿ¢⁄¢€æ˘ƒÐ πÀ·–‘∏þ√ÃÀ·ºÿ»Ð“∫Õ …´
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–Õº æ”Î∂‘”¶µƒ– ˆ≤ªœý∑˚µƒ «
A.Õº1±Ì æœýÕ¨Œ¬∂»œ¬£¨œÚpH£Ω10µƒ«‚—ıªØƒ∆»Ð“∫∫Õ∞±ÀÆ÷–∑÷±º”ÀÆœ° Õ ±pHµƒ±‰ªØ«˙œþ£¨∆‰÷–a±Ì æ∞±ÀÆœ° Õ ±pHµƒ±‰ªØ«˙œþ
B.Õº2±Ì æœÚ∫¨”–…Ÿ¡ø«‚—ıªØƒ∆µƒ∆´¬¡À·ƒ∆»Ð“∫÷–µŒº”—ŒÀ·À˘µ√≥¡µÌŒÔ÷ µƒ¡ø”ΗŒÀ·Ãª˝µƒπÿœµ
C.Õº3±Ì æ—π«ø∂‘ø…ƒÊ∑¥”¶CO(g)£´H2O(g)![]() CO2(g)£´H2(g)µƒ”∞œÏ£¨““µƒ—π«ø±»º◊µƒ—π«ø¥Û
CO2(g)£´H2(g)µƒ”∞œÏ£¨““µƒ—π«ø±»º◊µƒ—π«ø¥Û
D.Õº4±Ì æ10 mL 0.01 mol°§L£≠1KMnO4À·–‘»Ð“∫”Îπ˝¡øµƒ0.1 mol°§L£≠1H2C2O4»Ð“∫ªÏ∫œ ±£¨n(Mn2£´)ÀÊ ±º‰µƒ±‰ªØ(Mn2£´∂‘∏√∑¥”¶”–¥þªØ◊˜”√)
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com