
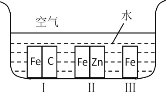
【题目】(1)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(2)氟氯代烷是一种能破坏臭氧层的物质。在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2。上列的反应的总反应式是_________,少量氟氯代烷能破坏大量臭氧的原因是______________。
【答案】Ⅰ、Ⅲ、Ⅱ 2O3→3O2 氟氯代烷分解产生的Cl对O3的分解有促进作用
【解析】
(1)金属腐蚀的速度:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀;
(2)将方程式①②③相加得出氧气和臭氧的关系式;根据Cl+O3→ClO+O2判断氟氯代烷能破坏大量臭氧的原因。
(1)铁处于Ⅰ的环境中做原电池的负极,腐蚀速率较快,铁处于Ⅱ的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于Ⅲ的环境中的金属铁发生化学腐蚀,速度较慢;故答案为:Ⅰ、Ⅲ、Ⅱ;
(2)由①Cl+O3→ClO+O2、②O3→O+O2、③ClO+O→Cl+O2,将方程式①+②+③得方程式:2O3→3O2;氟氯代烷受紫外线的照射分解出氯原子,Cl+O3→ClO+O2,Cl对O3的分解有促进作用,所以能破坏臭氧层;故答案为:2O3→3O2;氟氯代烷分解产生的Cl对O3的分解有促进作用。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】图为氢氧燃料电池的装置示意图,下列说法正确的是

A. 该装置能将化学能转化为电能
B. 通入氧气的电极为负极
C. 电子由电极B经导线流向电极A
D. 正极反应式为:H2 – 2e- = 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以银精矿(主要成分为Ag2S)为原料采用“预氧化湿法提银”工艺流程如下:
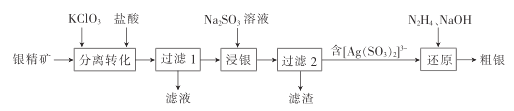
(1)N2H4的电子式为________________________。
(2)“分离转化”时,Ag2S转化为AgCl和S的化学方程式为______________(ClO3-还原为Cl- );为提高Ag2S的转化率可采取的措施是_____________(列举2条)。已知:Ksp(Ag2S)=1. 6×10-49 ,Ksp(AgCl)=2. 0×10-10 ,若不加KClO3,直接加氯化物,依据反应Ag2S+2Cl-![]() 2AgCl+S2- ,能否实现其较完全转化?并说明理由:________________
2AgCl+S2- ,能否实现其较完全转化?并说明理由:________________
(3)“浸银”时,发生反应的离子方程式为________________________。
(4)“还原”时,2[ Ag(SO3)2]3- +N2H4+2OH -=2Ag↓+4SO32- +N2↑+H2↑+ 2H2O,该反应每生成1 mol Ag转移电子的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H为抗肿瘤药物吡柔比星的活性物质,其一种合成路线如下:
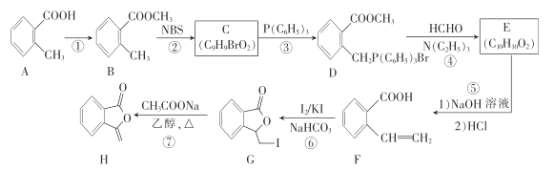
回答下列问题:
(1)A的化学名称是______________。
(2)反应①所需的试剂和条件是__________________。
(3)C的结构简式为_________________。
(4)写出E到F的反应方程式:___________________。
(5)⑦的反应类型是___________________________。
(6)芳香化合物X是H的一-种同分异构体,X中除苯环外不含其他环状结构,X能发生银镜反应、水解反应,写出X的结构简式:____________________________(只需写出3种)。
(7)设计以环已醇(![]() )为原料制备
)为原料制备![]() 的合成路线[无机试剂、P(C6H5)3及N(C2H5)3任用]。________________
的合成路线[无机试剂、P(C6H5)3及N(C2H5)3任用]。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。只改变一个条件,则下列对图像的解读正确的是
①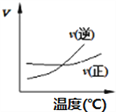 ②
②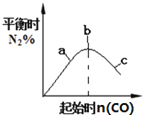 ③
③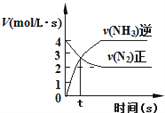 ④
④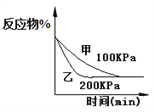
A. A2(g)+3B2(g)![]() 2AB3(g),如图①说明此反应的正反应是吸热反应
2AB3(g),如图①说明此反应的正反应是吸热反应
B. 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
C. N2(g)+3H2(g)![]() 2NH3(g),如图③说明t秒时合成氨反应达到平衡
2NH3(g),如图③说明t秒时合成氨反应达到平衡
D. 2A(g)+2B(g)![]() 3C(g)+D(?),如图④说明生成物D一定是气体
3C(g)+D(?),如图④说明生成物D一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是制造染料的重要原料。某同学在实验室里用下图装置制取硝基苯,主要步骤如下:
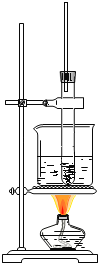
①在大试管里将2mL浓硫酸和1.5mL浓硝酸混合,摇匀,冷却到50~60℃以下。然后逐滴加入1mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60℃的水浴中加热10分钟。
完成下列填空:
(1)指出图中的错误__、__。
(2)向混合酸中加入苯时,“逐滴加入”、“边滴边振荡试管”的目的是________________、____________。
(3)反应一段时间后,混合液明显分为两层,上层呈__色,其中主要物质是__(填写物质名称)。把反应后的混和液倒入盛有冷水的烧杯里,搅拌,可能看到__。(选填编号)
a.水面上是含有杂质的硝基苯
b.水底有浅黄色、苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
(4)为了获得纯硝基苯,实验步骤为:
①水洗、分离;
②将粗硝基苯转移到盛有__的烧杯中洗涤、用__(填写仪器名称)进行分离;
③__;
④干燥;
⑤__。
(5)实验装置经改进后,该同学按照上述实验步骤重新进行了多次实验,充分反应后有两种情况出现,请帮助他作出
①产率低于理论值,原因是__;
②产率高于理论值,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是( )
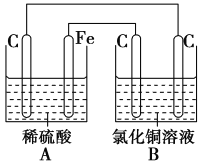
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
D.经过一段时间,B烧杯中溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为铁在一定条件下的转化关系图。

请回答:
(1)“曾青得铁则化为铜”的反应有:Fe + CuSO4 = FeSO4 + Cu,该反应的还原剂是_____________(填化学式);
(2)工业上,向500-600℃的铁屑中通入Cl2生产FeCl3,向FeCl3溶液中滴加KSCN溶液,观察到的现象是溶液变成____________色;
(3)图2为原电池装置示意图,此装置可以把化学能转化为_________能,其中铁作_____极;

(4)Fe3O4中Fe既有+2价又有+3价,则+2价和+3价Fe的个数比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇燃料电池采用硫酸作为电解质溶液,是一种可再生清洁的电池,电池的示意图如图,电池总反应式为C2H5OH+3O2=2CO2+3H2O。
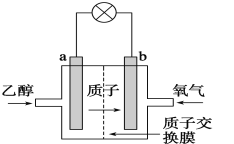
(1)a是___极(选“正”或“负”),发生___反应;电流由___极流向___极(选“a”或“b”),SO42-移向___极(选“a”或“b”)。
(2)随着电池的不断放电,硫酸溶液的物质的量浓度将___。(选“变大”或“不变”或“变小”)
(3)电池的负极电极反应式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com