
【题目】硝基苯是制造染料的重要原料。某同学在实验室里用下图装置制取硝基苯,主要步骤如下:
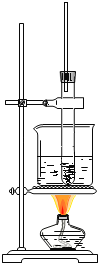
①在大试管里将2mL浓硫酸和1.5mL浓硝酸混合,摇匀,冷却到50~60℃以下。然后逐滴加入1mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60℃的水浴中加热10分钟。
完成下列填空:
(1)指出图中的错误__、__。
(2)向混合酸中加入苯时,“逐滴加入”、“边滴边振荡试管”的目的是________________、____________。
(3)反应一段时间后,混合液明显分为两层,上层呈__色,其中主要物质是__(填写物质名称)。把反应后的混和液倒入盛有冷水的烧杯里,搅拌,可能看到__。(选填编号)
a.水面上是含有杂质的硝基苯
b.水底有浅黄色、苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
(4)为了获得纯硝基苯,实验步骤为:
①水洗、分离;
②将粗硝基苯转移到盛有__的烧杯中洗涤、用__(填写仪器名称)进行分离;
③__;
④干燥;
⑤__。
(5)实验装置经改进后,该同学按照上述实验步骤重新进行了多次实验,充分反应后有两种情况出现,请帮助他作出
①产率低于理论值,原因是__;
②产率高于理论值,原因是__。
【答案】缺少温度计 大试管接触烧杯底部 使苯与混酸混合均匀 能及时移走反应产生的热量 浅黄色 硝基苯、苯 b、d 氢氧化钠溶液 分液漏斗 水洗、分离 蒸馏 温度过高引起硝酸的分解、苯的挥发 温度过高,有其他能溶于硝基苯的产物生成
【解析】
⑴水浴加热需精确控制实验温度;为使受热均匀,试管不能接触到烧杯底部;
⑵苯不易溶于混酸,需设法使之充分混合;该反应放热,需防止温度过高;
⑶混合酸密度比硝基苯大,但稀释后会变小,硝基苯无色,但溶解的杂质会使之有色;
⑷粗硝基苯中主要含未反应完的酸和苯,酸可用水和碱除去,苯可用蒸馏的方法分离;
⑸在本实验中使用的硝酸易分解、苯易挥发,有机反应的一个特点是副反应比较多,这些因素会使产率降低或使得实验值偏离理论值,而这些因素都易受温度的影响。
⑴在水浴装置中为了精确控制实验温度,需要用温度计测量水浴的温度;为使受热均匀,试管不能接触到烧杯底部,所以在图中错误为缺少温度计、大试管接触烧杯底部。答案为:缺少温度计;大试管接触烧杯底部;
⑵在向混合酸中加入苯时边逐滴加入边振荡试管,能使苯与混酸混合均匀;苯的硝化反应是一个放热反应,在向混合酸中加入苯时边逐滴加入边振荡试管,能及时移走反应产生的热量,有利于控制温度,防止试管中液体过热发生更多的副反应,甚至发生危险。答案为:使苯与混酸混合均匀;能及时移走反应产生的热量;
⑶混合酸与苯反应一段时间后,生成的硝基苯与未反应的苯相溶,有机层密度比混酸小,不能与混酸相溶,会浮在混合酸的上层,有机层因溶解了少量杂质(如浓硝酸分解产生的NO2等)而呈浅黄色,所以反应一段时间后,混合液明显分为两层,上层呈浅黄色;把反应后的混合液倒入盛有冷水的烧杯里,搅拌:
a.与水混合后,形成的水层密度比硝基苯小,硝基苯不在水面上,a选项错误;
b.苦杏仁味的硝基苯密度比水层大,沉在水底,且因溶有少量杂质而呈浅黄色,b选项正确;
c.烧杯中的液态有机物有硝基苯、苯及其它有机副产物,c选项错误;
d.反应后的混和液倒入冷水中,可能有部分未反应的苯浮上水面,苯为无色、油状液体,d选项正确;
答案为:浅黄色;硝基苯、苯;b、d;
⑷在提纯硝基苯的过程中,硝基苯中有酸,能与碱反应,硝基苯中有苯,与硝基苯互溶,所以操作步骤为:①水洗、分离,除去大部分的酸;②将粗硝基苯转移到盛有氢氧化钠溶液的烧杯中洗涤、用分液漏斗进行分离,除去剩余的酸;③水洗、分离,除去有机层中的盐及碱;④干燥;⑤蒸馏,使硝基苯与苯及其它杂质分离。答案为:氢氧化钠溶液;分液漏斗;水洗、分离;蒸馏;
⑸本实验中反应为放热反应,需控制好温度。如果温度过高会导致硝酸的分解、苯的挥发,使产率降低;温度过高会也有不易与硝基苯分离的副产物产生并溶解在生成的硝基苯中,使实验值高于理论值。答案为:温度过高引起硝酸的分解、苯的挥发;温度过高,有其他能溶于硝基苯的产物生成。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
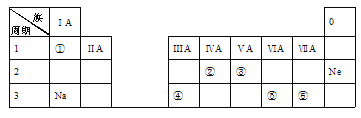
(1)④的原子序数是________;
(2)⑤的原子结构示意图是____________;
(3)②和③两种元素的非金属性强弱关系是:②______③(填“>”、“<”或“=”);
(4)①和⑥两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
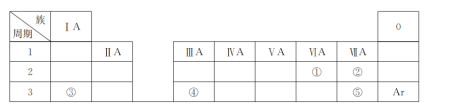
(1)①的元素符号是________;
(2)②和⑤的原子半径大小关系是②________⑤(填“>”“<”或“=”);
(3)③和⑤形成的化合物含有的化学键是__________(填“离子键”或“共价键”);
(4)③、④的最高价氧化物对应的水化物相互反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)![]() 3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是
3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是
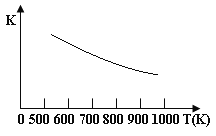
A.H2S是还原剂
B.脱除H2S的反应是放热反应
C.温度越高H2S的脱除率越大
D.压强越小H2S的脱除率越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
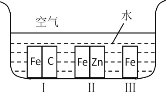
(2)氟氯代烷是一种能破坏臭氧层的物质。在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2。上列的反应的总反应式是_________,少量氟氯代烷能破坏大量臭氧的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:R-CH=CH-O-R′![]() R-CH2CHO + R′OH(烃基烯基醚)
R-CH2CHO + R′OH(烃基烯基醚)
烃基烯基醚A的分子式为C12H16O。与A相关的反应如下:

完成下列填空:
43、写出A的结构简式_______________________________。
44、写出C→D化学方程式____________________________________________________。
45、写出一种满足下列条件的F的同分异构体的结构简式________________________。
①能与FeCl3溶液发生显色反应;
②光照时与氯气反应所得的一氯取代产物不能发生消除反应 ;
③分子中有4种不同化学环境的氢原子。
46、设计一条由E合成对甲基苯乙炔(![]() )的合成路线。
)的合成路线。
(无机试剂任选)。合成路线流程图示例如下:_________________________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池的正极材料是含锂的钴酸锂(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,用LiC6表示。电池反应为CoO2+LiC6![]() LiCoO2+C6,下列说法正确的是( )
LiCoO2+C6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-=Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠用于汽车的安全气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气,其与酸反应可生成氢叠氮酸(HN3),常用于引爆剂,氢叠氮酸还可由肼(N2H4)制得。下列叙述错误的是
A.CO2、N2O与N3-互为等电子体
B.氢叠氮酸(HN3)和水能形成分子间氢键
C.NaN3的晶格能小于 KN3的晶格能
D.HN3和 N2H4都是由极性键和非极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
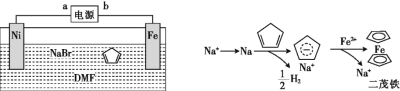
A.a为电源的负极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为Fe+2C5H6![]() Fe(C5H5)2+H2↑
Fe(C5H5)2+H2↑
D.二茂铁制备过程中阴极的电极反应为2H++2e-![]() H2 ↑
H2 ↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com