
【题目】铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)![]() 3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是
3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是
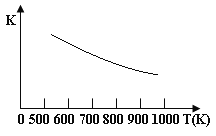
A.H2S是还原剂
B.脱除H2S的反应是放热反应
C.温度越高H2S的脱除率越大
D.压强越小H2S的脱除率越高
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
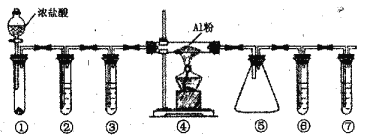
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。如图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是( ){已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
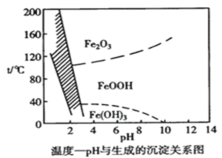
A.在25℃时溶液经氧化,调节溶液pH=4,此时溶液中c(Fe3+)=2.64×10-9mol·L-1
B.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
C.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
D.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究碳与浓H2SO4反应的产物,将浓H2SO4和木炭反应产生的气体进行以下实验:
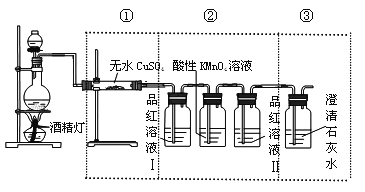
(1)气体通过无水硫酸铜,固体变蓝。说明气体中含有__________;
(2)气体通入品红溶液,溶液褪色;微热,溶液恢复红色。说明气体中含有__________(填“SO2”或“CO2”);
(3)气体通入足量的澄清石灰水,产生白色沉淀。该小组认为气体中含有CO2,你认为该结论:__________(填“正确”或“不正确)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H为抗肿瘤药物吡柔比星的活性物质,其一种合成路线如下:
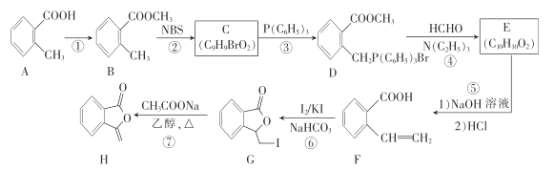
回答下列问题:
(1)A的化学名称是______________。
(2)反应①所需的试剂和条件是__________________。
(3)C的结构简式为_________________。
(4)写出E到F的反应方程式:___________________。
(5)⑦的反应类型是___________________________。
(6)芳香化合物X是H的一-种同分异构体,X中除苯环外不含其他环状结构,X能发生银镜反应、水解反应,写出X的结构简式:____________________________(只需写出3种)。
(7)设计以环已醇(![]() )为原料制备
)为原料制备![]() 的合成路线[无机试剂、P(C6H5)3及N(C2H5)3任用]。________________
的合成路线[无机试剂、P(C6H5)3及N(C2H5)3任用]。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有0.6molCl-、0.8 molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则
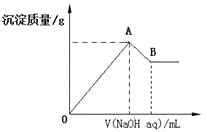
A.x=![]()
B.x的取值范围是0<x<11/32
C.A点横坐标的值随x发生变化
D.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是制造染料的重要原料。某同学在实验室里用下图装置制取硝基苯,主要步骤如下:
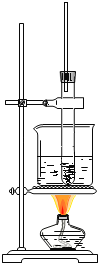
①在大试管里将2mL浓硫酸和1.5mL浓硝酸混合,摇匀,冷却到50~60℃以下。然后逐滴加入1mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60℃的水浴中加热10分钟。
完成下列填空:
(1)指出图中的错误__、__。
(2)向混合酸中加入苯时,“逐滴加入”、“边滴边振荡试管”的目的是________________、____________。
(3)反应一段时间后,混合液明显分为两层,上层呈__色,其中主要物质是__(填写物质名称)。把反应后的混和液倒入盛有冷水的烧杯里,搅拌,可能看到__。(选填编号)
a.水面上是含有杂质的硝基苯
b.水底有浅黄色、苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
(4)为了获得纯硝基苯,实验步骤为:
①水洗、分离;
②将粗硝基苯转移到盛有__的烧杯中洗涤、用__(填写仪器名称)进行分离;
③__;
④干燥;
⑤__。
(5)实验装置经改进后,该同学按照上述实验步骤重新进行了多次实验,充分反应后有两种情况出现,请帮助他作出
①产率低于理论值,原因是__;
②产率高于理论值,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
2PbSO4(s)+2H2O(l),现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
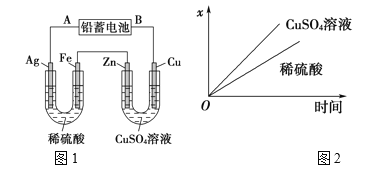
(1)A是铅蓄电池的________极,铅蓄电池正极反应式为:______。
(2)Ag电极的电极反应式是______,该电极的电极产物共________g。
(3)Cu电极的电极反应式是________,CuSO4溶液的浓度_______(填“减小”“增大”或“不变”)。
(4)如图2表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示_______。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶解氧(指溶解在水体中氧气分子)是衡量水质的一个重要指标。为测定某水样中溶解氧含量(ρ=![]() )设计了如下实验方案。实验步骤如下:
)设计了如下实验方案。实验步骤如下:
步骤1:水样的采集与固定
用水样瓶准确量取100mL的待测水样(不能留有气泡),并用针筒向水样下方快速注入2.0mLMnSO4溶液和3.0mL碱性KI溶液,盖好瓶盖,上下颠倒摇匀,此时生成Mn2+在碱性条件下被水中的氧气氧化为MnOOH棕色沉淀,静置至澄清。
步骤2:碘的游离
向水样瓶中加入3.0mL浓硫酸,使I-在酸性条件下被MnOOH氧化为I2,同时MnOOH被还原Mn2+,待沉淀完全溶解后,将它们全部转移到250mL锥形瓶中。
步骤3:碘的滴定
向锥形瓶中加入少量淀粉溶液,再滴加0.005mol·L-1的Na2S2O3标准溶液,恰好完全反应时,消耗Na2S2O3标准溶液的体积为16mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)MnOOH中Mn元素的化合价是___。
(2)写出步骤2中所发生反应的离子方程式___。
(3)若待测水样中留有气泡,则测定结果将___。(填“偏大”、“偏小”或“无影响”)
(4)计算该水样中溶解氧的含量ρ(以mg·L-1表示),并写出计算过程:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com