
【题目】重量法测定硫酸铜晶体结晶水含量时,会引起测定值偏高的是( )
A.未作恒重操作
B.硫酸铜部分分解
C.硫酸铜晶体未完全失水
D.坩埚放在空气中冷却
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )。

A. 图①:验证H2CO3酸性强于H2SiO3 B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5 D. 图④:分离C2H5OH与CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO2和H2催化氢化可以制取甲烷。
(1)已知 ①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH= -572 kJ·mol-1
③H2O(l)=H2O(g) ΔH= +44 kJ·mol-1
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=a kJ·mol-1
CH4(g)+2H2O(g) ΔH=a kJ·mol-1
据此,a=_________;升高温度,该反应的v(逆)_____(填“增大”或“减小”)。
(2)在一定压强、不同温度下,两种催化剂分别催化CO2加氢甲烷化反应2h的结果如图1所示(一定温度下仅改变催化剂,其他条件不变):a、b-催化剂I; c、d-催化剂II。甲烷化选择性:指含碳产物中甲烷的物质的量分数。请据图1分析:
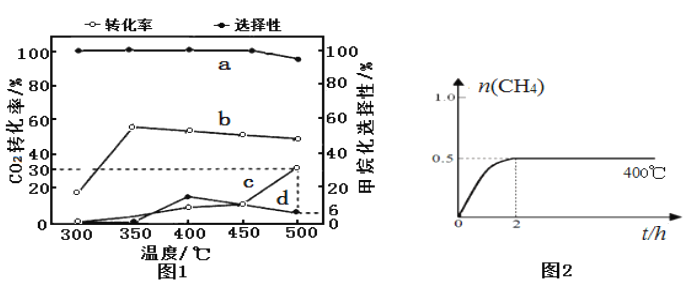
①催化剂I实验,400 ℃~450℃时CO2转化率下降的原因可能为___________(写1条)。
②催化剂II实验,检测密闭容器中产物发现,温度升高甲烷的选择性下降是发生了:CO2(g)+ H2(g)![]() CO(g)+H2O(g) ΔH>0。若保持温度不变,提高甲烷化选择性可以采取的措施:______________(写2条)。
CO(g)+H2O(g) ΔH>0。若保持温度不变,提高甲烷化选择性可以采取的措施:______________(写2条)。
(3)下列与甲烷化反应有关的描述中,正确的是______:
A.单位时间内断裂1molC=O键的同时断裂1molC-H,说明该反应已达平衡
B.照上述反应使用催化剂,其Ⅰ的活化能比Ⅱ的活化能大
C.在绝热的密闭容器中进行时,当容器中温度不变时说明达到平衡
D.催化剂Ⅰ下,300-450℃内,选择性保持不变的主要原因是其它副反应的速率很慢
(4)催化剂I实验, 400℃时,向2L固定体积的密闭容器中通入1mol CO2和4mol H2,CH4物质的量随时间的变化趋势如图2时所示,则2h内H2平均反应速率为____________;平衡常数K=____________。若其他条件不变,反应在恒压条件下进行,请在图2中画出反应体系中n(CH4)随时间t变化的趋势图____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:

(1)H中含氧官能团的名称为_____、_____。
(2)D的系统命名是___________;J的结构简式为_____________。
(3)由A生成B的化学方程式为_______________________,反应类型__________。
(4)C与银氨溶液反应的化学方程式为_______________________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_______________。
(6)G的同分异构体中核磁共振氢谱有4组峰,且能与FeCl3溶液发生显色反应,写出其中两种符合上述条件的同分异构体的结构简式_________________________。
(7)写出由物质A、甲醛、液溴为原料合成“2一苯基乙醇”的路线图:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同物质的溶液酸碱性不同,根据下表中pH的情况判断,下列说法中不正确的是( )
盐酸 | CuSO4溶液 | NaCl溶液 | 水 | Na2CO3溶液 | NaOH溶液 | |
pH | <7 | <7 | =7 | =7 | >7 | >7 |
A.酸溶液一定显酸性
B.显碱性的溶液不一定是碱溶液
C.盐溶液一定显中性
D.盐溶液不一定显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________。
(2)生产流程中加入过量铁屑的目的是___________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________;试设计实验证实该金属阳离子的存在:____________________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式: ________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com